- Корзина пуста.
Из книги: Химический анализ в медицинской диагностике.- М.: Наука, 2010.- С.293-368
Осипов Г.А.
В основе метода — высокоточное определение специфических маркерных молекул, входящих в состав клеточных липидов микроорганизмов. Высокочувствительный и селективный метод газовой хроматографии – масс спектрометрии (ГХ-МС) позволяет одновременно измерять концентрации более сотни микробных маркеров непосредственно в анализируемом материале: крови, моче, биоптатах и других биологических жидкостях и тканях, а также в небиологических пробах, минуя стадии предварительного посева на питательные среды или использование тестовых биохимических материалов. Разработан автоматический алгоритм анализа с помощью штатных программ ГХ-МС, позволяющих определить численность более 50 клинически значимых видов микроорганизмов в материале в течение трех часов с момента его поступления в лабораторию.
Оглавление
- Введение
- История метода
- Основные типы клеточных жирных кислот и альдегидов микроорганизмов
- Хроматография и масс-спектрометрия маркеров микроорганизмов
- Верификация метода
- Клинические приложения метода
- Заключение
Ι. Введение
Применяемые на сегодняшний день в клинической практике методы определения микроэкологического статуса организма человека, а также диагностики инфекций имеют определенные ограничения и недостатки. Например, существенным недостатком классического бактериологического исследования, помимо дороговизны и длительности (7-10 дней), является невозможность оценить роль некультивируемых микроорганизмов в инфекционно-воспалительном процессе, прежде всего – анаэробов. Используемый в качестве дополнительного к классическому, иммуно-серологический метод является непрямым, поскольку выявляет не возбудителя, а иммунный ответ на него, который может иметь индивидуальные вариации. Известные молекулярно-биологические методы, при несомненных преимуществах — прямое определение возбудителя, высокие специфичность и чувствительность, универсальность, скорость, возможность диагностики хронических и латентных инфекций – имеют такие серьезные недостатки, как частые ложноположительные результаты и невозможность адекватной количественной оценки1,2,3.
Из всего вышесказанного вытекает очевидная востребованность в надежном количественном экспресс-методе диагностики дисбактериозов и определения возбудителей инфекции. Такими свойствами обладает метод масс-спектрометрии микробных маркеров (МСММ), основанный на количественном определении маркерных веществ микроорганизмов (жирных кислот, альдегидов, спиртов и стеринов) непосредственно в клиническом материале. 4,5,6 В этом принципиальное отличие метода, придающее ему качественно новое свойство – возможность разложения суперпозиции всего пула микробных маркеров, что позволяет оценить вклад от каждого из сотен видов микроорганизмов, которые обитают, например, в кишечнике7,8. Метод является высокочувствительным, быстрым (2,5 часа на полный цикл исследования), универсальным, экономичным и имеет широкий диагностический спектр. Он легко поддается стандартизации, для его реализации используются доступные любым лабораториям химические реактивы и методики пробоподготовки. Метод автоматизирован, что обуславливает простоту лабораторной диагностики. Диагностические возможности метода для выявления микробных маркеров в клинических материалах представляются перспективными. Внедрение ГХ-МС позволяет сократить время и стоимость исследования, минуя стадии повторных пересевов первичных колоний и тестовых ферментаций, которые особенно сложны, трудоемки и длительны для анаэробов. Метод позволяет не только определять маркерные вещества (жирные кислоты, альдегиды, спирты и стерины) в чистых культурах микроорганизмов, выделенных из клинического материала по известной технологии9,10, но и количественно определять состав микробного сообщества, который кроется за набором маркеров конкретной пробы.11,12,13 Материалом для исследования в клинике служат кровь, слюна, моча, ликвор, синовиальная или асцитическая жидкость, мокрота, мазки из зева, носовых и слуховых проходов, секреты половых органов, биоптаты и экссудаты тканей, смыв с кожи — в зависимости от конкретно решаемой задачи.
Технология отработана на хромато-масс-спектрометрах АТ 597х D фирмы Agilent Technologies, США, и аналогичных приборах фирм Shimadzu (Япония), Micromass (Великобритания), Finnigan (США-Россия), состоящих из собственно масс-спектрометра, соединенного с ним хроматографа, системы вакуумной откачки и системы управления, сбора и обработки данных. Для реализации метода принципиально необходимо, чтобы ГХ-МС система обеспечивала работу в режиме селективных ионов (синонимы масс-фрагментография, Single Ion Monitoring). Масс-спектрометр квадрупольный с диапазоном масс 2-1000 аем, должен иметь разрешающую способность 0,5 аем во всем рабочем диапазоне. Чувствительность прибора 50 пг по метил-стеарату в режиме непрерывного сканирования и 1 пг в режиме селективных ионов. Для анализа используют кварцевую капиллярную колонку с неподвижной фазой типа НР-5 ms.
Методу ГХ-МС микробных маркеров присущи:
- широкий диагностический спектр: определение маркеров десятков микроорганизмов одновременно в одном анализе;
- универсальность: определение разных групп микроорганизмов: бактерий, грибов, вирусов;
- экспрессность: время одного анализа не более 3 часов
- высокая чувствительность: 01 нг/мл маркера
- селективность: определение микроорганизма до вида — при наличии видового маркера
- независимость от оснащения микробиологической лаборатории и возможность прямого анализа клинических образцов без высевания и подращивания
- экономичность: метод не требует биологических и биохимических тестовых материалов, культуральных сред, ферментов, праймеров.
Для проведения экспресс-анализа маркеров микроорганизмов требуются: хромато-масспектрометр, программа расчета и база данных.
ΙΙ. История метода
Появление новых высокочувствительных аналитических систем в микробиологии сделало возможным изучение химического состава микроорганизмов, что привело к развитию хемотаксономии.14 Различие в химическом составе микробов послужило основанием для их классификации и появлению различных методик идентификации по какому-либо химическому веществу или группе веществ.14,15,16 В конце 60-х Abel одним из первых применил сведения о составе жирных кислот (ЖК) липидов цитоплазматической мембраны (ЦПМ) для дифференциации микроорганизмов. С тех пор был описан состав почти всех известных видов. Изучением их ЖК профилей занимались C.W. Moss17, E. Jantzen18, A. Sonesson19, а в СССР Л.В. Андреев20, З.П. Васюренко15. Серии работ посвящены хемодифференциации клинически важных микроорганизмов.10,16,21 Метод маркера, т.е. выявление присутствия микроорганизма определенного рода или вида по присущему ему одному химическому веществу, используется в различного рода анализах при изучении окружающей среды.22,23 Однако его возможности в области практической медицины мало изучены. Известна диагностика кандидомикоза по арабинитолу24, попытки обнаружения микроорганизмов, содержащих в эндотоксине -оксимиристиновую кислоту25, диагностика менингококка26, гонококка27,видов Haemophylus28 по специфическим оксикислотам. Они получили развитие в работах L. Larsson и его учеников.29,30,31.
Кроме ЖК, для хемодифференциации использовали ДНК, рибосомальную РНК, олигопептиды и белки ЦПМ, сахара, изопреноидные хиноны, фосфолипиды, нейтральные липиды, различные продукты метаболизма14. Для хемодифференциации используют в основном хроматографию: газовую, газожидкостную, с детекторами электронного захвата, масс-спектрометрическими, пламенно-ионизационными детекторами; иногда высокоэффективную жидкостную хроматографию, хроматографию в тонком слое, электрофоретические методы. 32,33
Из всех перечисленных методов наиболее практичным оказалась газовая хроматография и фирма Hewlett-Packard рискнула выпустить в 1987 г. специализированный хроматограф с методикой и математическим обеспечением для идентификации бактерий по составу жирных кислот и альдегидов (MIS — microbial identification system). Вскоре его производство было передано фирме MIDI Inc (Delaware, США). В настоящее время система носит название MIS MIDI “Sherlock” и широко используется за рубежом для быстрой и недорогой идентификации микроорганизмов в экологии, медицине и биотехнологии.
Газовая хроматография с масс-спектрометрией (ГХ-МС) показала себя как наиболее быстрый и чувствительный метод с высокой разрешающей способностью. Первоначально он применялся для изучения природных микробных сообществ. Этим занимался D.C.White и его группа34 (Nichols 1987), и многочисленные его последователи, работающие методом PLFA (phospholipid fatty acids). Заслуга D.C.White состоит в обосновании специфичности жирных кислот фосфолипидов микроорганизмов в структуре и свойствах микробных сообществ. Этому обязано распространение метода в изучении микробиологии подземной биосферы, донных отложений водоемов и почв. Параллельно исследования велись в России, не только в области экологии13,35, но и, в отличие от зарубежных авторов, в области специальной (медицинской) микробиологии. В результате был разработан метод анализа клинически важного микробного сообщества организма человека.12,16 Он отличается от зарубежных прототипов применением режима селективных ионов вместо полного сканирования масс-спектра и введением вместо одного маркера – сразу 150 маркеров, перекрывающих все изученное многообразие микроорганизмов в природе.
В этой главе книги описаны клинические применения метода масс-спектрометрии микробных маркеров. Этот мультиионный метод ГХ-МС анализа состава микробных сообществ in-situ был разработан на базе исследований НИИ биологического приборостроения Минмедбиопрома6 при поддержке академика РАН Г.А.Заварзина и гранта Министерства экологии и охраны недр РФ «Экологическая безопасность России» (1993 г.). Методология анализа микробных сообществ методом ГХ-МС распространена при поддержке академиков РАМН Ю.Ф. Исакова, А.А.Воробьева, В.Ф. Учайкина, проф. Б.А. Шендерова, проф. Н.В.Белобородовой, проф. А.С.Парфенова на диагностику воспалительных процессов и дисбиозов в медицине, проф. Н.В.Верховцевой – в почвах, агроценозах, илах, подземной биосфере и других экосистемах.35,36,37,38 Суммарно метод в приложении к экологическим и клиническим проблемам изложен в докторских диссертациях Г.А. Осипова16 (1996), И.Н. Ручкиной39 (2005), И.В. Полеско40 (2009), десяти кандидатских диссертациях, а также в статьях отечественной и зарубежной периодики, пособиях для врачей. Часть материала представлена в Интернете на сайте www.rusmedserv.com/microbdiag на русском и www.rusmedserv.com/microbdiag/eng на английском языках.
ΙΙΙ. Основные типы клеточных жирных кислот и альдегидов микроорганизмов
Бактериям свойственно большое разнообразие ЖК и жирных альдегидов. В настоящее время их насчитывают более двухсот пятидесяти. В организме человека их всего около двадцати пяти. Это обстоятельство определяет возможность родового или видового анализа инфекций и дисбиозов на преобладающем фоне биологической жидкости непосредственно в клиническом материале.
ЖК в бактериях входят в состав различных классов липидов: фосфолипидов, гликолипидов, гликофосфолипидов, орнитин- и лизинсодержащих липидов, ацилглицеринов, эфиров жирных кислот, липопротеинов и липополисахаридов наружной мембраны грамотрицательных бактерий, некоторых других липидов41. Их содержание у большинства бактерий составляет 2 — 10 %. Длина цепи ЖК бактерий в основном составляет 10-20 атомов углерода. У многих таксономических групп преобладают ЖК с прямой цепью. Из насыщенных жирных кислот в наибольшем количестве содержится гексадекановая (пальмитиновая), из ненасыщенных — цис-9,10-гексадеценовая (пальмитолеиновая) и цис-11, 12-октадеценовая (цис-вакценовая). Последнюю считали ранее маркером патогенных бактерий (псевдомонады, энтеробактерии и другие), однако в организме человека в норме ее присутствие в основном определяется лактобациллами. Транс-вакценовая кислота характерна для Nocardia asteroides. Реже у бактерий встречается цис-9, 10-октадеценовая (олеиновая) кислота, обычно содержащаяся в липидах эукариот14,15,16. Для бактерий не характерны полиненасыщенные ЖК, однако у некоторых из них (р.р. Mycobacterium, Vibrio, Flexibacterium и др.) они обнаружены. 10,14
Жирные кислоты с разветвленной цепью встречаются в изо-форме с локализацией метильной группы у предпоследнего атома углерода и антеизо-форме с локализацией метильной группы у 3-го от конца атома углерода. Преобладание в жирнокислотном спектре кислот с разветвленной цепью характерно для бактерий значительного числа таксономических групп: р.р. Bacillus, Bacteroides, Staphylococcus, Legionella, многочисленных видов актинобактерий – р.р. Streptomyces, Corynebacterium, Mycobacterium и других42,43,44. Коринебактериям и микобактериям, присуще наличие 10-метилоктадекановой (туберкулостеариновой) кислоты с локализацией метильной группы у 10-го атома углерода, а родококки имеют в клеточной стенке 10-метил-гексадекановую кислоту, которая является хорошим маркером клинически значимого вида Rhodococcus equi.14,42
Гидроксикислоты содержат ОН-группу у 2-го или 3-го атома углерода (соответственно a- и b-гидроксикислоты). Главным образом, они являются компонентами липида А липополисахаридов грамотрицательных бактерий. Основной кислотой, связанной амидной связью в липиде А липополисахаридов Salmonella, Escherichia, Proteus, Klebsiella, Bordetella, является 3-гидрокситетрадекановая (b-гидроксимиристиновая, 14:0 3ОН) кислота. Одно время она считалась маркером E.coli, потом – сем. Enterobacteriaceae, пока не накопились данные по другим бактериям. Оказалось, что 14:0 3ОН- кислота содержится также в клетках фузобактерий, нейссерий, гемофильной палочки и других микроорганизмов. Виды Pseudomonas, Acinetobacter, Moraxella, Neisseria, Hydrogenophaga имеют в ЛПС 2- и 3-гидрокси-додекановые (a- и b-гидроксилауриновые) и 3-гидроксидекановую кислоты в разных соотношениях, что позволяет различать их по родам в сообществах. В ЛПС бактерий группы Bacteroides-Cytophaga-Flexibacter, Stenotrophomonas, Selenomonas, Chriseobacterium meningosepticum, Prevotella, Flavobacterium, Sphingobacterium определены также нечетные разветвленные и прямоцепочечные a- и b- гидроксикислоты10. Помимо более распространенных b-гидроксикислот в состав липополисахаридов многих бактерий входят a-гидроксикислоты. Штаммы Salmonella, Alcaligenes и Enterobacter cloacae содержат 2-гидрокситетрадекановую (a-гидроксимиристиновую) кислоту, а Bordetella bronchiseptica и Pseudomonas aeruginosa – 2-гидроксидодекановую (a-гидроксилауриновую) кислоту.
В состав липидов многих бактерий входят уникальные жирные кислоты – циклопропановые, образующиеся из мононенасыщенных жирных кислот. Циклопропановые жирные кислоты имеют цис— конфигурацию. Для бактерий видов Lactobacillus, Pseudomonas, Brucella, Helicobacter и других характерна цис –11,12-метиленоктадекановая (лактобацилловая) кислота, происходящая из цис-вакценовой кислоты и цис-9,10-метиленгексадекановая кислота у представителей сем. Enterobacteriaceae (маркер семейства).
К настоящему времени состав жирных кислот большинства микроорганизмов изучен, показана его воспроизводимость, доказана их родо- и видоспецифичность9. Метод детектирования микроорганизмов по ЖК-маркерам сходен с генетическим анализом (ПЦР, определение последовательности нуклеотидов 16sРНК и пр.), поскольку состав жирных кислот детерминирован в ДНК и воспроизводится путем репликации участка генома транспортными РНК и последующего синтеза ЖК в митохондриях по матричным РНК. Т.е, профиль ЖК так же консервативен, как и строение ДНК. Исследования в области бактериальной палеонтологии подтвердили постоянство состава ЖК отдельных микроорганизмов и пула их жирных кислот, в целом, с глубины времен в 2.5 млрд. лет. 35 Наиболее часто встречающиеся в клинических пробах ЖК, альдегиды и стерины перечислены в таблице 1 с отнесением к вероятным таксонам микроорганизмов.
Таблица 1
Высшие жирные кислоты альдегиды и стерины в составе клеточной стенки с отнесением к микроорганизмам, у которых они наиболее часто встречаются (вещества приведены в порядке возрастания числа атомов углерода в цепи молекулы, что соответствует хроматографическому времени удерживания).
| № | Обозначение* | Название | Микроорганизмы |
| Жирные кислоты | |||
| 1. | С10 | Декановая | Streptococcus |
| 3. | i11 | Изоундекановая | Stenotrophomonas, |
| 4. | C12:0 | Лауриновая | Arcobacter, |
| 6. | iC12 | Изолауриновая | Peptostreptococcus anaerobius |
| 7. | iC13 | Изотридекановая | Stenotrophomonas maltophilia, Bacillus subtilis, |
| 8. | а13 | Антеизотридекановая | Bacillus cereus, Brevibacterium |
| 9. | 13:0 | Тридекановая | Selenomonas |
| 10. | i14 | Изомиристиновая | Streptomyces, Bacillus, актинобактерии |
| 11. | 14:1D9 | 9,10- тетрадеценовая | Clostridium, Streptococcus pneumoniae |
| 12. | 14:1D11 | 11,12-тетрадеценовая | Simonsiella, Nocardia, Kingella kingae |
| 13. | 14:0 | Миристиновая | Lactobacillus, Helicobacter, Campylobacter, Streptococcus, Clostridium |
| 14. | 2Me14 | 2-метил-тетрадекановая | Mycobacterium gordonae |
| 15. | i15:1 | Изопентадеценовая | Flavobacterium |
| 16. | 15:1D9 | 9,10-пентадеценовая | Clostridium propionicum, Bacteroides hypermegas |
| 17. | i15 | Изопентадекановая | Propionibacterium, Bacteroides |
| 18. | а15 | Антеизопентадекановая | Staphylococcus, Bacillus, коринеформные бактерии |
| 19. | 15:0 | Пентадекановая. | Большинство видов микроорганизмов, минорный компонент, Selenomonas, Clostridium sporogenes, Bacteroides succinogenes, Bact. ruminicola, Pseudomonas stutzeri |
| 20. | i16:1 | Изогексадеценовая | Desulfovibrio |
| 21. | 16:1D7 | 7,8-гексадеценовая | Clostridium ramosum, Streptococcus |
| 22. | 16:1D9 | 9,10-гексадеценовая | Большинство видов микроорганизмов |
| 23. | 16:1D11 | 11,12-гексадеценовая | Ruminococcus |
| 24. | i16:0 | Изопальмитиновая | Streptomyces, Nocardiopsis, |
| 25. | 10Ме16 | 10-метилгексадекановая | Rhodococcus |
| 26. | 16:0 | Пальмитиновая | Большинство видов микроорганизмов |
| 27. | i17:1 | Изопентадеценовая | Campylobacter mucosales |
| 28. | 17:1 | Гептадеценовая | Mycobacterium, Candida albicans |
| 29. | i17:0 | Изогептадекановая | Bacillus, Propionibacterium, Prevotella |
| 30. | a17:0 | Антеизогептадекановая | Corynebacterium, Bacteroides, Nocardiopsis, Nocardia |
| 31. | 17сус | Циклогептадекановая | сем. Enterobacteriaceae |
| 32. | 17:0 | Гептадекановая | Большинство видов микроорганизмов, минорный компонент |
| 33. | 18:4 | Октадекатетраеновая | Некоторые грибы и дрожжи |
| 34. | 18:3 | Линоленовая | Грибы и дрожжи |
| 35. | 18:2 | Линолевая | Грибы, дрожжи, простейшие |
| 36. | 18:1D9 | Олеиновая | Все организмы |
| 37. | i18:1 H | Enterococcus faecalis | |
| 38. | 18:1D11 | Цис-вакценовая | Lactobacillus, Streptococcus, Pseudomonas, Cardiobacterium hominis |
| 39. | 18:0 | Стеариновая | Многие микроорганизмы |
| 40. | i18 | Изооктадекановая | Peptostreptococcus, Bifidobacterium, Nocardiopsis, Bacillus subtilis, Clostridium difficile |
| 41. | 10Me18 | 10-метил-октадекановая, (туберкулостеариновая) | рр. Mycobacterium, Nocardia; вв. Corynebacterium bovis, C. гр. xerosis, C.urealyticum, |
| 42. | 11Me18:1 | 11-метилоктадеценовая | Afipia, Helicobacter mustelae |
| 43. | 19cyc | Циклононадекановая | Lactobacillus, Enterococcus, Pseudomonas, Brucella, Campylobacter, сем. Enterobacteriaceae, Helicobacter pylori |
| 44. | i19 | Изононадекановая | Bacillus subtilis, Bacteroides hypermegas |
| 45. | а19 | Антеизононадека-новая | Staphylococcus |
| 46. | 19:0 | Нонадекановая | Nitrobacter, Bacillus, Serratia; Burkholderia cepacia |
| 47. | i19:1 | Изо-нонадеценовая | Afipia |
| 48. | 20:1 | Эйкозеновая | Propionibacterium jensenii, , Streptococcus thermophilus, St. salivarius, St. mutans, Actinomyces |
| 49. | 20:0 | Эйкозановая | Actinomyces |
| 50. | 20:1D11 | 11-эйкозеновая | Streptococcus mutans |
| 51. | 21:0 | Бегеновая | Francisella |
| 52. | 22:6 | Докозагексеновая | грибы, эукариоты |
| 53. | 22:0 | Докозановая | Francisella |
| 54. | С22:4 | Арахидоновая кислота | Простейшие и высшие организмы |
| 55. | 24:0 | Тетракозановая | Francisella, Mycobacterium, микроэукариоты |
| 56. | 25:0 | Пентакозановая | Микроэукариоты |
| 57. | 26:0 | Гексакозановая | Mycobacterium, микроэукариоты |
| Гидроксикислоты | |||
| 58. | 3h10 | 3-гидроксидекановая | Bordetella pertussis, B. parapertussis, Pseudomonas syringae, P. alcaligenes, P. stutzeri, P. mendocina,. Comamonas |
| 59. | 2h10 | 2-гидроксидекановая | Pseudomonas |
| 60. | 3hi11 | 3-гидроксиизо-ундекановая | Stenotrophomonas maltophilia, |
| 61. | 2hi11 | 2-гидроксиизоундека-новая | Stenotrophomonas maltophilia, |
| 62. | 3h12:1 | гидроксидодеценовая | Pseudomonas aeruginosa |
| 63. | 3h12 | 3-гидроксилауриновая | Acinetobacter, Pseudomonas, Vibrio; Neisseria, Moraxella, Arcobacter, Eikenella, Suttonella, Kingella |
| 64. | 2h12 | 2-гидроксилауриновая | P. putida, P.aeruginosa, Acinetobacter, Alcaligenes, Bordetella |
| 65. | 3hi13 | 3-гидроксиизо-тридекановая | Stenotrophomonas maltophilia, |
| 66. | 3h13 | 3-гидрокситридекановая | Selenomonas; Bacteroides hypermegas, |
| 67. | 3h14 | 3-гидроксимиристиновая | Alcaligenes, Fusobacteriun, Haemophilus, Wolinella, Campylobacter, Neisseria, Burkholderia, сем. Enterobacteriaceae |
| 68. | 2h14 | 2-гидроксимиристиновая | Alcaligenes, Salmonella |
| 69. | 2,3hi14 | 2,3-дигидроксиизотет-радекановая | Legionellа |
| 70. | 3h15 | 3-гидрокси-пентадекановая | Bacteroides ruminicola |
| 71. | 3hi15 | 3-гидроксиизопентаде-кановая | Flavobacterium, Prevotella, Bacteroides melaninogenicus, |
| 72. | 2hi15 | 2-гидроксиизо-пентадекановая | Flavobacterium |
| 73. | 3ha15 | 3-гидроксиантеизо-пентадекановая | Bacteroides ruminicola |
| 74. | 3h16 | 3-гидрокси-пальмитиновая | Erwinia, Brucella, Bacteroides, Wolinella, Cytophaga, Flexibacter, Fusobacterium, Bordetella; Burkholderia, P. pseudomallei, Campylobacter fetus, C. sputorum, C. fecalis |
| 75. | 2h16 | 2-гидрокси-пальмитиновая | Flexibacter; Alcaligenes, Burkholderia cepacia, Ralstonia pickettii (2h16:1), клетки эпителия, спермий и другие эукариотические клетки |
| 76. | 3hi16 | 3-гидроксиизо-пальмитиновая | Riemerella |
| 77. | 3hi17 | Гидроксиизо-гептадекановая | Bacteroides, Flavobacterium, Cytophaga, Riemerella |
| 78. | 2hi17 | 2-гидроксиизо-гептаде-кановая | Bacteroides |
| 79. | 3h17 | 3-гидрокси-гептадекановая | Bacteroides ruminicola, B. thetaiotaomicron |
| 80. | 3ha17 | 3-гидроксиантеизо-гептадекановая | Bacteroides ruminicola |
| 81. | 10h18:1 | 10-гидрокси-октадеценовая | Clostridium perfringens |
| 82. | 3h18 | 3-гидроксистеариновая | Francisella (F. philomiragia), Brucella, Achromobacter, Helicobacter pylori |
| 83. | 2h18 | 2-гидроксистеариновая | Простейшие |
| 84. | 10h18 | 10-гидроксистеариновая | Clostridium perfringens |
| 85. | 9,10 epoxy18 | 9,10-эпоксиоктадека-новая | Pneumocistis carinii |
| 86. | 3h20 | 3-гидроксиэйкозановая | Chlamydia trachomatis |
| 87. | 3hi20 | 3-гидроксиизо-эйкозановая | Chlamydia trachomatis, Legionella |
| 88. | 3h22 | 3-гидроксидокозановая | Chlamydia trachomatis |
| Спирты | |||
| 89. | 16alc | n-пальмитиновый | Moraxella |
| 90. | 18alc, 2-OH | Стеариновый, 2-ОН | Mycobacterium MAIS, n18 – Moraxella |
| 91. | 20alc | n-эйкозиловый | Mycobacteria |
| 92. | 2h20alc | 2-оксиэйкозиловый | Mycobacterium tuberculosis |
| 93. | 2h22alc | 2-оксидокозиловый | Mycobacterium xenopii |
| 94. | 2h24alc | 2-окситетракозиловый | Mycobacterium |
| 95. | 2h26alc | 2-оксигексакозиловый | Mycobacterium |
| Альдегиды: | |||
| 96. | 12a | Лауриновый | Butyrivibrio |
| 97. | 13a | Тридекановый | Butyrivibrio, Selenomonas |
| 98. | i14a | Изомиристиновый | Bifidobacterium, Butirivibrio |
| 99. | 14:1D9a | 9,11-тетрадеценовый | Butyrivibrio, Clostridium fimetarum |
| 100. | 14:1D11a | 11,12-тетрадеценовый | Butyrivibrio, Clostridium fimetarum |
| 101. | 14а | Тетрадекановый | Butyrivibrio, Bifidobacterium, Spirochaeta, |
| 102. | i15a | Изопентадекановый | Butyrivibrio, Lactobacillus (rumen), Propionibacterium |
| 103. | a15a | Антеизопентадекановый | Butyrivibrio, Eubacterium, Frigoribacterium, Propionibacterium freudenreichii |
| 104. | 15:1а | Пентадеценовый | Butyrivibrio |
| 105. | 15а | Пентадекановый | Butyrivibrio |
| 106. | 16:1D9а | 9,10-гексадеценовая | Butyrivibrio, Selenomonas, Lactobacillus, Eubacterium, Mobiluncus, Peptostreptococcus anaerobius |
| 107. | 16:1D11a | 11,12- гексадеценовый | Clostridium fimetarum |
| 108. | 16a | Пальмитиновый | Clostridium fallax, Lachnospira, Butyrivibrio, Lactobacillus |
| 109. | i17a | Изогептадекановый | Propionibacterium freudenreichii |
| 110. | a17a | Антеизогептадекановый | Eubacterium, в. Propionibacterium freudenreichii |
| 111. | 17суса | Циклогептадекановый | Clostridium |
| 112. | 17a | Гептадекановый | Lactobacillus (rumen) |
| 113. | i18a | Изостеариновый | рр. Eubacterium, Lachnospira, Butyrivibrio, Bifidobacterium, Selenomonas, Mobiluncus, Clostridium butiricum |
| 114. | 18:1a | Октадеценовый | Eubacterium, Clostridium |
| 115. | 18а | Стеариновый | Clostridium thermocellum |
| 116. | а16а | Антеизопальмитиновый | Clostridiun acetobutilicum, Cl. butiricum |
| 117. | 19суса | Циклононадекановый | Lactobacillus |
| 118. | 19а | Нонадекановый | Clostridium turobutiricum |
| Стерины | |||
| 119. | Копростанол — холестанол | Eubacterium | |
| 120. | Холестендиол | Простой герпес | |
| 121. | Холестадиенон | Цитомегаловирус | |
| 122. | Пневмоцистерол | Pneumocystis carini, P. hominis | |
| 123. | Кампестерол | Микроскопические грибы | |
| 124. | Эргостерол | Aspergillus, Mucor и др., содержащие эргостерол | |
| 125. | Ситостерол, β-сито-стерол | Микроскопические грибы, растения | |
| 126. | Холестерин | Простейшие и высшие организмы | |
* — Обозначения веществ: 17:1 — 17- число атомов углерода, цифра после двоеточия — число двойных связей; h — оксикислота; а,i — в начале означает разветвление; cyc — циклопропановая кислота. Например, ha17 — 3-окси-антеизогептадекановая кислота.
**- имеется в виду 3-оксикислоты, если не указано положение гидроксила
Для отнесения маркеров к конкретным микроорганизмам наряду с авторскими данными (740 штаммов микроорганизмов) использована база данных (2000 штаммов) прибора Шерлок (MIDI Inc, Delaware, USA) для хроматографической идентификации микроорганизмов по жирным кислотам. Привлечены также сведения из литературных источников для получения представлений о реальном составе сообщества микроорганизмов в тканях и биологических жидкостях человека в норме и при патологических изменениях, а также о составе высших жирных кислот и альдегидов их клеточных стенок.10,18,42,45 Кроме того, на веб-сайтах некоторых микробных коллекций в свободном доступе наряду с последовательностями гена 16S рРНК имеются также и жирнокислотные профили многих изолятов.
На основании известных данных о наиболее распространенных в организме человека микроорганизмов46 составлена локальная база данных состава жирных кислот, которая использована для выявления маркеров и составления расчетных формул. Ниже приводится обоснование принадлежности маркеров конкретным микроорганизмам, предполагаемым обитателям стенки кишечника, а также выбор конкретного маркера или схемы расчета для вычисления их концентрации.
Bifidobacterium. Численность бифидобактерий измеряли по компоненту специфического липида клеточной мембраны — плазмологена, в котором одна из жирных кислот глицерида заменена жирным альдегидом. Для бифидобактерий отличительным является октадеценовый альдегид47, который и регистрировали в качестве меры их концентрации.
Lactobacillus. Лактобациллы имеют четкие маркеры — лактобацилловую кислоту47 и цис-вакценовую (18:1D11), которые встречается и у других бактерий, например, псевдомонад и энтеробактерий. Однако, псевдомонады редко обнаруживаются в кишечнике в заметных концентрациях, а перекрестное определение с энтеробактериями учитываются в уравнении баланса концентраций ЖК с использованием дополнительных маркеров. Здесь для контроля лактобацилл принята цис-вакценовая кислота.
Семейство Enterobacteriaceae. Энтеробактерии близки по профилю ЖК, при этом допускают родовую (иногда – видовую) дифференциацию в чистой культуре клеток, но вряд ли различимы в целом при одновременном присутствии в сообществе микроорганизмов. Их маркеры b-оксимиристиновая кислота (h14), циклогептадекановая (17cyc) и цис-вакценовая кислоты10,47,15 имеют ранг семейства, при многочисленных перекрестах с представителями других семейств. Здесь, при отсутствии псевдомонад реально оценивать количество энтеробактерий в целом по концентрации 17cyc.
Klebsiella. Клебсиеллы среди других членов семейства Enterobacteriaceae имеют отличительный признак — 2-оксимиристиновую кислоту (собственные измерения) в составе ЛПС, которая в данном сообществе оказывается маркером рода.
Eubacterium. Представители этого рода являются одними из основных обитателей кишечника. Их маркер, дегидрохолестерол (копростанол) является продуктом интерактивного метаболизма Eubacterium и клеток организма-хозяина48. Для дифференциации эубактерий на уровне вида и подвида использованы их различия в составе жирных альдегидов (табл. 2) . Кроме того, виды Eubacterium определяли по специфическим жирным альдегидам47, в том числе E.lentum по изо-гексадекановому альдегиду (i16a), группу штаммов этого вида, включая 7741 и другие, у которых лидирует в профиле тетрадекановый альдегид49 (14а).
Propionibacterium. Для детектирования пропионобактерий использованы изо- и антеизо-гептадекановые альдегиды (i17а и a17a) согласно базе данных MIDI Inc и нашим собстаенным измерениям состава ЖК штамма типового вида Propionibacterium freudenreichii из Всероссийской коллекции микроорганизмов (ВКМ) .
Peptostreptococcus anaerobius. Известно, что этот микроорганизм имеет в профиле ЖК редко встречающиеся четные изокислоты с числом атомов углерода от десяти до шестнадцати.50 Нами использованы в качестве маркера изо-додекановая (i12) и изо-тетрадекановая (i14) кислоты.
Ruminococcus. Определяли по 11-гексадеценовой кислоте, обнаруженной нами в природных изолятах руминококков.51
Propionobacterium acnes. Для определения этого организма использован (собственные данные) изо-пентадекановый альдегид (i15a), после вычета вклада эубактерий.
Bacillus. Присутствие бацилл видов B.cereus и B.subtilis можно детектировать по специфическим разветвленным кислотам с 13 атомами углерода: i13 и а13.43 B.megaterium определяли по остатку антеизо-пентадекановой (ai15) кислоты в уравнении баланса.
Acinetobacter. В качестве родового признака удобно использовать 2-оксидодекановую кислоту при наличии 3-оксидодекановой. 10
Clostridium ramosum и ее группа (C. inocuum, C. clostridioforme), а также неопределенно большая группа других видов клостридий47, отличаются высоким содержанием в мембране 7-гексадеценовой (16:1D7) кислоты.
Clostridium perfringens. Имеет четкие маркеры, характерные для группы клостридий, включающей, кроме C. perfringens, также С. histolyticum и C.oedematiens. Это 10-оксистеариновая и 10-оксиоктадеценовая кислоты, легко определяемые по специфическим ионам в масс-спектре16. Эти вещества не являются клеточными компонентами самих клостридий, а связаны с разложением клеток ткани макроорганизма бактериальными ферментами.52
C.difficile и другие клостридии. C.difficile отличаются от других клостридий наличием составе ЖК изо-октадекановой (i18) кислоты, C.hystolyticum – изо-тетрадеценовой.53
Bacteroides. Анаэробные бактерии группы B.fragilis имеют хороший маркер — пару разветвленных оксикислот: гидрокси-изо-гептадекановую (hi17) и антеизогептадекановую (ha17).54,55,56 Численность остальных бактероидов оценивали по остатку в балансе гидрокси-гексадекановой кислоты.
Streptococcus. Многие стрептококки “невидимы” на фоне компонентов биологической жидкости из-за совпадения собственных жирных кислот с кислотами субстрата. Однако группа оральных стрептококков (a-стрептококки), S. salivarius и др., имеющих в составе декановую кислоту С1057, а также мононенасыщенные кислоты 16:1D7 и 18:1D1147.
- mutans – анаэробный стрептококк, его отличительным признаком является 11-эйкозеновая кислота 20:1ω9.47 Могут быть перекрестные определения с некоторыми клостридиями.
Enterococcus. Энтерококки группы Enterococcus faecalis, E. faecium также могут быть обнаружены при их лидерстве в сообществе по лактобацилловой (19cyc) кислоте47, если сами лактобациллы определены по 18:1D11.
Candida albicans, Mycobacterium. Специфическим признаком микроскопических грибов C.albicans в липидной фракции биологических жидкостей человека является гептадеценовая кислота [собственные данные]. Нельзя исключить, что он может относится так же к нетуберкулезным микобактериям, обитающим во рту и кишечнике, например Mycobacterium terrae, известные участием в инфекционных процессах.58
Микроскопические грибы. Неспецифическим маркером клинически значимых микроскопических грибов (Aspergillus, Candida, Mucor и др.) является эргостерол59, а также кампестерол и ситостерол60 (собственные измерения).
Flavobacterium (Sphyngobacterium, Chriseobacterium). Эти бактерии имеют разветвленные нечетные 2-оксикислоты в составе клеточных сфинголипидов (2hi15, 2hi17), которые могут служить маркерами в клинических пробах.10
Streptomyces, Nocardiopsis. В профилях ЖК биологических жидкостей пациентов присутствует значительное количество изогексадекановой кислоты i16, существенно превышающее возможную долю P. anaerobius и Bacillus, имеющих это вещество в составе клеточной мембраны. Редкими организмами (из известных нам), обладающих этим признаком являются представители рода Streptomyces и некоторых других актиномицетов (например, Nocardiopsis dasonviley, выделенный нами из биоптата слизистой оболочки кишечника). Штаммы стрептомицетов, имеющие до 40% i16 в профиле жирных кислот описаны в литературе61. Имеются также данные об участии стрептомицетов в колонизации и воспалениях различных органов человека.42
Actinomadura. Определяли по 10-метил-гептадекановой кислоте (10Ме17) за вычетом вклада родококков42
Pseudonocardia. К этому роду аэробных актиномицетов отнесена изо-гексадеценовая кислота (i16:1), так же за вычетом родококков.42
Rhodococcus. Наиболее вероятно родококами обусловлено наличие в составе жирных кислот всех исследованных нами проб 10-метил-гексадекановой кислоты (10Ме16).42
Nocardia. Определяли по изомеру тетрадеценовой (предположительно, 14:1d11) кислоты, обнаруженному нами в изоляте нокардий из клинической пробы. Nocardia asteroides и другие виды определяли по транс-9,10-гексдеценовой кислоте (16:1ω7t).42
Helicobacter pylori. Практически везде в клинических пробах присутствует гидрокси-октадекановая кислота (h18). Эта оксикислота характерна для рода Francisella и вида Helicobacter pylori.62 В нашем случае логично отнести наличие h18 к Helicobacter pylori или к F.filomiragia. H. pylori традиционно связывают с хроническим гастритом, однако его обнаруживают в тканях больных с изязвлениями языка63, атеросклеротических бляшках64 и абсцессе печени. Кроме того, ГХ-МС анализ штаммов, выделенных из биоптатов кишечника в данной работе, показал наряду с традиционно известными для H. pylori ЖК (18:1d11, 16:0, 19cyc, 3h16, 3h18) наличие 11Ме18:1, 2h18:1 и 11-ОМе-19. По данным определителя неферментирующих грамотрицательных бактерий10 в профиле ЖК H. pylori присутствует 11Ме18:1 (под обозначением 19:1br) и неидентифицированный компонент с относительным временем удерживания 19,735, совпадающий с определенным нами RRT=19,733 для 11-оксиметил-нонадекановой кислоты.
Campylobacter mucosalis. Этот вид имеет в составе жирных кислот редкую изо-гептадеценовую (i17:1) кислоту47, по которой проводили его мониторинг, при учете вклада бактерий родов Chriseobacterium и Flavobacterium, если присутствовал их маркер 2hi15.
Fusobacterium spp., Haemophilus influenzae. Единственным отличительным компонентом в клеточных ЖК эти бактерий является 3-оксимиристиновая кислота (3h14)65, которая к тому же встречается и у других грамотрицательных организмов клинического значения, таких как E.coli, Klebsiella, Serratia и другие. Поэтому Fusobacterium, Haemophylus могут быть определены лишь по остатку в уравнении баланса для 3h14.
Staphylococcus. Известно, что стафилококки содержат нечетные изо- и антеизо- разветвленные кислоты с числом атомов углерода 15, 17 и 19.66 В качестве родового маркера в данном сообществе можно использовать антеизо-нонадекановую (ai19) кислоту.
Corinebacterium CDC groups. Listeria spp После учета всех микроорганизмов, имеющих в составе ЖК антеизо-гептадекановую кислоту, часто наблюдается остаток. Представляется наиболее вероятным отнести его за счет неучтенных коринебактерий, известных особенно высоким содержанием кислот а15 и а17, и по этому признаку выделенных в отдельную группу СDC A-3, A-4, A-5, B-1a, B-3a, B-1b, B3b, а также C. betae, Corinebacterium aquaticum, листерий и бревибактерий.67
Вирусы. При сопоставлении наших данных с данными анализа иммунным и генетическим методами ряда пациентов с различными патологиями мы обнаружили корреляцию в появлении метаболита холестерина холестендиола при инфекции вирусом герпеса и холестадиенона при инфицировании цитомегаловирусом.
Pseudomonas aeruginosa. Псевдомонады имеют четкие маркеры из состава С10 и С12 оксикислот10, которые допускают их ограниченную видовую дифференциацию даже на фоне биологической жидкости. В качестве родового признака удобно использовать 3-оксидекановую кислоту (3h10). Альтернативных микроорганизмов с таким признаком в биологических жидкостях человека нет. Для P. aeruginosa возможна видовая идентификация по специфичной для вида 2-оксидодекановой кислоте (2h12). В наших клинических штаммах P. aeruginosa обнаруживается еще один маркер – 3-оксидодекановая кислота (3-оксилауриновая кислота, 3h12). Кроме того у некоторых из них отсутствует 3-оксилауриновая кислота (3h12) по сравнению с известным из литературы соотношением 3h/2h изомеров равном 2/3 .
Mycobacterium spp. Неспецифическим тестом на микобактерии в методе ГХ или ГХ-МС является наличие туберкулостеариновой кислоты (10-метил-октадекановой — 10Me18) в очаге поражения46. Дополнительные данные, полученные за последнее время по 3-оксикислотам липидов микобактерий, позволяют предложить дополнительные маркеры для M.tuberculosis и других представителей рода. Маркером M. tuberculosis при этом оказалась 3-ОН-2,4,6-триметил-тетракозановая кислота23. Накопленный к настоящему времени материал по составу липидов микобактерий дает принципиальную возможность разработки метода их быстрого определения непосредственно в биологических жидкостях, используя селективность и чувствительность метода ГХ-МС.
Brucella, Francisella, Bacteroides ureolyticus. Эти микроорганизмы могут быть ассоциированными с 3-гидроксигексадекановой кислотой (3h16) в биологических жидкостях человека10. При конкретном отнесении маркера учитывают сопутствующие клинические факторы. При менингитах следует отнести его к Francisella filomiragia, а при инфекциях УГТ к Bacteroides ureolyticus. Другие бактероиды, виды Burkholderia и H. pylori также имеют эту кислоту, но их доля может быть учтена в расчетной формуле на основании величин их собственных маркеров и их соотношения с 3h16.
Chlamydia trachomatis. Этот внутриклеточный паразит имеет сразу три маркерных оксикислоты: 3-оксиэйкозановую (3h20), 3-окси-изоэйкозановую (3hi20) и 3-оксидокозановую кислоту (3h22), которые удобны для масс-спектрометрического детектирования.68
Prevotella melaninogenica определяется по относящемуся только к ней маркеру – 3-гидрокси-изопентадекановой кислоте (3hi15)55 .
Butyrivibrio/Clostridium fimetarum, бактерии пищеварительной системы жвачных животных, определяются по изопентадекановому альдегиду (i15a). На коже вклад в этот маркер дает также Propionibacterium acnes. 47
Некоторые вещества характерны для всех или большинства микроорганизмов: это пальмитиновая(16:0), стеариновая (18:0), миристиновая (14:0), олеиновая, лауриновая (12:0) кислоты и некоторые др. Кислоты с 18 и 16 атомами углерода присутствуют во всех клетках и не могут быть маркерами.
ΙV. Хроматография и масс-спектрометрия маркеров микроорганизмов
Суть анализа состоит в прямом извлечении с помощью экстракции высших жирных кислот, альдегидов и стеринов из подлежащего исследованию образца, их разделения на хроматографе в капиллярной колонке высокого разрешения и анализа состава на масс-спектрометре. Поскольку хроматограф соединен в едином приборе с масс-спектрометром и снабжен компьютером с соответствующими программами автоматического анализа и обработки данных, сам процес анализа занимает 30 мин, а с учетом времени пробоподготовки и расчета данных — не более трех часов. Его результатом является количественное определение состава микроорганизмов.
Образцы биологической жидкости или ткани обрабатывают сразу или замораживают и хранят при — 5/ -18 ºС в случае, когда немедленный анализ невозможен. Допускается транспортировка проб при нормальной температуре в течение пяти часов. Допускается длительное хранение в высушенном виде при необходимости дальней транспортировки или пересылки пробы по почте (высушивать при температуре 70-85 ºС).
При подготовке пробы к хромато-масс-спектрометрическому анализу жидкие пробы высушивают c добавлением равного по объему количества метанола и подвергают кислому метанолизу в 1М HCl в метаноле. Метанолиз проводят в 0,4 мл реактива на 10 –15 мг сухого остатка (40 мкл цельной крови) в течение 1 часа при 80С. На этой стадии происходит освобождение жирных кислот и альдегидов из сложных липидов микроорганизмов и других клеток жидкости в виде метиловых эфиров и диметилацеталей. Эти компоненты экстрагируют гексаном (400 мкл) в течение 5 мин, гексановый экстракт высушивают, а сухой остаток обрабатывают 20 мкл N,О-бис(триметил-силил)-трифторацетамида в течение 15 мин при 80С для получения триметилсилильных эфиров окси-кислот и стеролов. К реакционной смеси эфиров добавляют 80 мкл гексана и 1-2 мкл раствора вводят в инжектор ГХ-МС системы.
Кровь из пальца (или из вены), а также слюну или ликвор в количестве не менее 100 мкл отбирают в пробирку с гепарином или ЭДТА (цитрат не рекомендуется) и помещают в холодильник для хранения до момента анализа. Для анализа цельную кровь в количестве 40 мкл пипеткой переносят в виалу, емкостью 1,5 мл, с завинчивающейся крышкой с тефлонированной прокладкой, подсушивают (при снятой крышке) в термостате при 80ºС с добавлением 40 мкл метанола для ускорения сушки. Ликвор или слюну для анализа берут в количестве 80 мкл и подсушивают с добавлением 80 мкл метанола. К загустевшей пробе приливают 400 мкл 1М HCl в метаноле, завинчивают плотно крышкой и подвергают кислому метанолизу при 80ºС в течение одного часа. К охлажденной реакционной среде добавляют 300 нг стандарта (дейтерометиловый эфир тридекановой кислоты), растворенного в гексане. Затем проводят экстракцию двумя порциями по 200 мкл гексана, встряхнув смесь на вортексе и позволяя отстоятся в течение 5 мин при комнатной температуре. Экстракт переносят в чистую виалу, высушивают 7 мин при 80°С, и сухой остаток обрабатывают 20 мкл N,О-бис(триметилсилил)-трифторацетамида в течение 15 мин при 80°С при закрытой крышке. К реакционной смеси добавляют 80 мкл гексана и, при анализе с использованием автосемплера, переносят смесь в коническую вставку, которую помещают в ту же виалу, в которой проводили силилирование, и завинчивают ее плотно крышкой. В таком виде проба пригодна для анализа в течение недели, если она герметично закрыта и не происходит ее испарения. При ручном вводе пробы коническая вставка не нужна.
При анализе мочи пробу в центрифужной пробирке в количестве 5 мл выстаивают при 5 ºС до выделения осадка (1 час и более). Осадок с минимальным захватом мочи переносят пипеткой в невысокий бюкс (тигель, химический стакан) и упаривают при температуре 80оС с добавлением такого же объема метанола. Если осадок не образуется, на анализ берут 1 мл мочи и упаривают до вязко-жидкого или сухого состояния. Затем в сосуд, где проводили упаривание, вносят микропипеткой 0,6 мл 1 М HCl в метаноле и той же микропипеткой соскабливают осадок со дна сосуда. Переведя его во взвесь, переносят в виал и подвергают кислому метанолизу, согласно протоколу для крови.
Mокроту, гнойный экссудат, вагинальный секрет, эякулят и другие густые субстанции готовят к анализу так же, как кровь — подсушивают 100 мкл пробы (всю пробу) и подвергают кислому метанолизу.
Метанолиз биоптатов тканей (кишечник и другие слизистые оболочки — в количестве 4-8 мг, мышечная ткань – 40 мг), проводят в 0,4 мл 1М HCl в метаноле при 80°С в течение часа. Дальнейшие операции проводятся в той же последовательности, что и при приготовлении проб крови.
Для проведения анализа смесь эфиров в количестве 2 мкл вводят в инжектор ГХ-МС системы вручную или посредством автоматической системы ввода проб (автосэмплера), которая обеспечивает воспроизводимость времен удерживания хроматографических пиков и повышает точность автоматической обработки данных. Хроматографическое разделение пробы осуществляют на капиллярной колонке с метилсиликоновой привитой фазой типа HP-5ms длиной 25 м и внутренним диаметром 0,25 мм, газ-носитель — гелий. Режим анализа — программированный, скорость нагрева термостата колонки 7 ºС/мин в диапазоне 135 – 320 ºС. Выдержка при начальной температуре 1,5 мин. Температура испарителя – 250 ºС, интерфейса – 250 – 300 ºС. Масс-спектрометр — квадрупольный, с ионизацией электронами (70 эв) используют в режиме селективных ионов, или масс-фрагментографии (МФ), при периодическом сканировании до тридцати ионов в пяти интервалах времени. Интервалы и ионы выбирают таким образом, чтобы селективно детектировать маркеры определяемых видов микроорганизмов. В том числе используют сильный ион m/z = 87 в спектрах жирных кислот для детектирования малых количеств микробных кислот С12-С15, С17, С19. Ион 175 включают в каждый интервал, кроме пятого, для детектирования b-оксикислот, для которых он специфичен и интенсивен в спектре. Ионы 301, 315 и далее через 14 единиц массы включают в программу для подтверждения молекулярного иона оксикислот тридекановой, тетрадекановой и следующих в гомологическом ряду. Ион 312, как молекулярный, используют для выявления изомеров нонадекановой кислоты, важной для диагностики стафилококка и энтерококков. Полное сканирование используют эпизодически для идентификации компонентов в новых пробах или для разметки программы временных интервалов МФ. В таблице 3 показано распределение ионов по временным интервалам в программе ГХ-МС для анализа микробных маркеров в пробах биологических жидкостей и тканей человека с указанием детектируемых маркеров и соответствующих им микроорганизмов.
Таблица 2
Группы сканируемых ионов, маркеров и соответствующих микроорганизмов
| Группа | Начало (мин) | Ионы | Вещества | Микроорганизмы |
| 1 | 3,0 перед С10 | 87,1 | Общий ЖК от C10- до C16:Δ11 | Clostridium, Bacillus, Peptostreptococcus spp. , Ruminococcus, Nocardia asteroides |
| 175,2 | 3h (общий) | Neisseria spp., Acinetobacter | ||
| 259,2 | h10 (M-15) | Pseudomonas spp. | ||
| 287,3 | h12 (M-15) | Pseudomonas , Neisseria, Moraxella spp | ||
| 243,3 | 2h12 | P.aeruginosa, Acinetobacter | ||
| 241,2 | i,a15a | Butyrivibrio spp | ||
| 270,3 | i16 | Streptomyces spp. | ||
| 301,2 | hi13, h13 | Stenotrophomonas, Selenomonas | ||
| 75,1 | Жирные альдегиды | Propionibacterium, Eubacterium spp, | ||
| 90,1 | C13CD3 | Дейтеротридекановая кислота, внутренний стандарт | ||
| 103,1 | Жирные спирты | Компоненты кожного сала | ||
| 186,2 | 10:0 | Streptococcus (оральные) | ||
| 2 | 12,3 | 271,2 | 2h14 | Alcaligenes |
| после С16:1 | 175,2 | 3h, общий | Fusobacterum, сем.Enterobacteriaceae | |
| 315,3 | h14 М | Fusobacterium, Haemophylus Enterobacteriaceae | ||
| 103,1 | Компоненты кожного сала | |||
| 75,1 | Жирные альдегиды | Eubacterium lentum | ||
| 253,2 | i16a | Eubacterium lentum | ||
| 3 | 12,8 | 87,1 | i,a,n17:0; 10Me16; 18:1 Δ11 | Коринеформы CDC, Propionibacterium, Rhodococcus sp, Lactobacillus |
| 285,2 | 2h (общий), 2hi15 | Flavobacterium spp. | ||
| После 3h14 | 250,2 | 17cyc, i17:1 и 17:1 | Enterobacteriaceae, Candida, Campylobacter spp. | |
| 298,3 | i18 | Clostridium difficile | ||
| 175,2 | 3h общий | Prevotella spp. | ||
| 75,1 | Жирные альдегиды | Eubacterium spp., P. freudenreichii | ||
| 4 | 15,0 | 273,3 | 10h18, 10h16 | C. perfringens, Malassesia |
| после | 87,1 | ЖК (общий) | Staphylococcus, Actinomyces, Streptococcus mutans | |
| 18:1D11 | 75,1 | Жирные альдегиды | Bifidobacterium, Enterococcus spp. | |
| 281,3 | Δ9, Δ11-18:1a | Eubacterium, Bifidobacterium | ||
| 399,3 | hi20, h20 | Chlamidia trachomatis | ||
| 427,3 | h22 | Chlamidia trachomatis | ||
| 175,1 | 3h16, 3h18 | Prevotella, Bacteroides spp., Helicobacter pylori, Burkholderia | ||
| 312,3 | i,a,n19:0 | Staphylococcus, Mycobacteria spp. | ||
| 278,2 | 19cyc, 19:1; 11Me18:1 | Enterococcus sp Afipia, Helicobacter mustelae | ||
| 199,2 | 10Me18 | Mycobacteria, Corinebacterium spp. | ||
| 383,3 | 2h22 | Микроскопические грибы | ||
| 117 | 2h20alk | Mycobacterium tuberculosis | ||
| 5 | 23,0 | 411,3 | 2h24 | Микроскопические грибы |
| 370,3 | Копростанол | Eubacterium spp. | ||
| 456,3 | Холестендиол | Вирус герпеса | ||
| после h22 | 382,3 | Холестадиенон | Цитомегаловирус | |
| 363,3 | Эргостерол | Микроскопические грибы | ||
| 343,3 | Кампестерол | Микроскопические грибы | ||
| 472,3 | Метилхолестанол | Вирус герпеса | ||
| 396,3 | b-ситостерол | Микроскопические грибы |
Интервалы сканирования устанавливают по группам ионов следующим образом: 1 группа, — начало — за 0,5 минуты до выхода декановой кослоты, окончание -промежуток между С16:1 и С16:0; 2 группа – ее началом является время окончания 1-й группы, окончание — перед туберкулопальмитиновой кислотой — 10Ме16 (пик по иону 87 перед изогептадекановой кислотой — i17:0); 3 группа — окончание второй и время между 18:1D11 и 18:0, ближе к 18:0, чтобы обязательно измерить пик цис-вакценовой кислоты (18:1D11); 4 группа — окончание 3-й и 1мин после выхода С24:0; 5 группа — окончание 4-й и до выхода метаболитов холестерина, примерно пять минут после его пика, чтобы зафиксировать b-ситостерол (m=396) и метилхолестанол (m=472). Временные интервалы корректируют под параметры хроматографической колонки и ГХ-МС прибора пользователя.
Сбор данных состоит в измерении площадей пиков ионов определенной массы на селективной хроматограмме специфических веществ — маркеров микроорганизмов (рис. 1).

Рис. 1. Селективные хроматограммы жирных кислот (ион 87, верхний рисунок), жирных альдегидов (ион 75, рисунок в середине) и гидрокси-кислот (ион 175, нижний рисунок), экстрагированных из клинического материала, содержащего микроорганизмы и/или их маркеры. Обозначения веществ: 17:1 — 17- число атомов углерода, цифра после двоеточия — число двойных связей; h — оксикислота; а,i — в начале означает разветвление; аlc — в конце символов — спирт, cyc — циклопропановая кислота. Например, ha17 — 3-окси-антеизогептадекановая кислота, 2h24alc — 2-окситетракозиловый спирт.
Для этого набирают или вводят готовую программу формата Method в соответствии с принятыми в программном обеспечении ГХ-МС-системы способом и формой. Полученные хроматограммы обрабатывают автоматически, пользуясь соответствующей опцией штатной программы обработки данных. В приборах Agilent Technologies — это опция “Calculate” в меню “Quantitate” программы Enhanced Data Analysis. Частично, данные автоматической обработки требуют ручной проверки измерения пиков. Это относится к неполностью разделенным на хроматограмме пикам или малым пикам, находящимся в соседстве с более интенсивными. Их находят, руководствуясь закономерностями появления на хроматограмме, т.е. абсолютными и относительными временами удерживания, подтверждением дополнительными ионами и соотношением площадей ионов. Для облегчения поиска нужного иона используют шаблоны и масс-спектры в файле, полученном в режиме полного сканирования. В процессе приобретения навыков полезно пользоваться библиотекой масс-спектров и хроматографировать в том же режиме стандартные смеси ЖК, имеющиеся в продаже. Масс-спектры ЖК имеют характерные признаки в гомологических рядах, по которым после некоторого навыка оператор сможет определять вид кислоты, не тратя время на библиотечный поиск. При масс-спектрометрическом детектировании отпадает необходимость и в повторном пользовании стандартными смесями, так как для идентификации вещества в сомнительных случаях достаточно пяти параметров, заложенных в программе. Это абсолютное время удерживания, расположение пика относительно известного репера, характерные основной и дополнительный (контрольный) ионы и соотношение их площадей или интенсивностей. Типичные масс-спектры ЖК приведены на рисунках.

Рис2. Масс-спектр октадеценовой кислоты в виде метилового эфира. Молекулярный ион М=296

Рис 3. Масс-спектр октадекановой кислоты в виде метилового эфира. В гомологическом ряду нормальные ЖК отличаются между собой лишь молекулярным ионом (здесь М=298) и ионами М-31 и М-43, соответственно 267 и 255.

Рис 4 . Мас-спектр гексадеканового альдегида в виде диметилацетали (ДМА) — 16a. В гомологическом ряду ДМА отличаются характерным ионом М-59. Здесь ион с массой 255.

Рис 5. Масс-спектр β-гидроксимиристиновой кислоты (14:0 3ОН) в виде Ме-ТМС производного. Общий характерный ион ряда 3-гидрокси ЖК m=175, характерный ион, свидетель молекулярного (М-15), здесь m=315.

Рис 6. Масс-спектр α-гидроксилауриновой кислоты (12:0 2ОН) в виде Ме-ТМС производного. Общий характерный ион ряда 2-гидрокси ЖК m=159, характерные ионы, свидетель молекулярного (М-15), здесь m=287 и 243 (M-59).

Рис 7. Масс-спектр 10-гидроксистеариновой кислоты (18:0 10ОН) в виде Ме-ТМС производного. Характерные ионы m=273 и 215, а также свидетель молекулярного иона m=371 (M-15).

Рис 8. Масс-спектр цикло-гептадекановой (17cyc) кислоты, молекулярный ион M=282. Специфический ион ряда M-32 (здесь ион m=250)
Существуют некоторые общие закономерности расположения пиков жирных кислот и альдегидов при анализе в виде Ме-ТМС производных на неполярных колонках и программируемом режиме анализа, которые иллюстрируются на рис 10 и 11. На рисунке 9 показана хроматограмма по полному ионному току гексанового экстракта метанолизата цельной крови больного. Она представляет мажорную группу ЖК форменных элементов и плазмы крови. Это пальмитиновая 12,54 мин, стеариновая 15,23 мин, пара ненасыщенных С18 кислот (олеиновая и линолевая) – около 14,92 мин, полиненасыщенные С20 кислоты во главе с арахидоновой 16,93 мин, полиненасыщенные докозеновые (С22:5 и другие) 19,26 мин, С24:0 и С24:1 около 22-й минуты, С22:6 24,00 мин, холестерин 26,52 мин

Рис.9. Хроматограмма гексанового экстракта метанолизата цельной крови больного. Снята в режиме полного сканирования в диапазоне масс 50-550.

Рис. 10. Масс-хроматограмма по иону 87 (жирные кислоты) пробы крови. Насыщенные прямоцепочечные ЖК 14:0 — 9,6 мин; 15:0 – 11,1 мин; 16:0 12,54 мин; 17:0 – 13,9 мин; 18:0 – 15,23 мин; 19:0 – 16,5 мин; 20:0 – 17,7 мин; 21:0 – 18,9 мин; 22:0 – 20,01 мин; 23:0 – 21,1 мин; 24:0 – 22,16 мин

Рис. 11 Масс-хроматограмма по иону 87 (жирные кислоты) пробы гексанового экстракта метанолизата фекалий. Здесь удобнее показать разветвленные и ненасыщенные кислоты: i14 – 9,03 мин; i15, a15 – 10,8 мин; i16 – 12,2 мин; i17, a17 – 13,6 мин; i18 – 14,9 мин; 16:1ω9 и ω7 – 12,4 мин; 18:2 – 15,1 мин; 18:1 ω9 – 15,15 мин; 18:1 ω7c – 15,20 мин
Нормальные прямоцепочечные ЖК образуют сетку маркерных пиков, которые выходят через равные промежутки времени. Их место при необходимости можно находить, пользуясь этой закономерностью и подтверждая молекулярным ионом и характерными линиями масс-спектра. Антеизо-кислоты выходят раньше нормальных на 0,35 мин, изо-кислоты на 0,5 мин, мононенасыщенные расположены между антеизо-кислотами и соответствующими им нормальными кислотами по оси времени. Оксикислоты появляются сразу после нормальной кислоты, которая на два атома углерода больше, чем сама оксикислота (рис 1). Причем 2h изомер сдвинут относительно 3h варианта на +0,05 мин). Оксилауриновые кислоты (h12) выходят спустя 0,3 мин после С14:0, у следующих кислот в ряду эта задержка уменьшается до нуля для оксиоктадекановых кислот. 10-оксистеариновая (m=273) и 3-оксистеариновая (m=175) кислоты близки по времени выхода с С20:0. Общим для простых ЖК является ион 87, для оксикислот — ион 175, жирных альдегидов – ион 75.
Расчет концентрации маркеров и отнесение их к конкретным микроорганизмам проводят по программному комплексу, который состоит из метода сбора и обработки данных – файл формата method.m и перевод их в формат электронных таблиц EXCEL. Лист 1 таблиц содержит площади пиков масс-фрагментограмм с указанием иона, по которому они измерены
Численности микроорганизмов определяют по формулам с учетом возможного происхождения ЖК из клеток разных таксонов. А именно, площадь пика маркера пропорциональна его концентрации, следовательно, концентрации соответствующего микроорганизма, которая определяется как число клеток N1 в единице объема или веса пробы по формуле:
N1=Ai[Mst/(q2×Msam×Ast)]/Ri1, где выражение в квадратных скобках, постоянный коэффициент:
к = Mst/(q2 × Msam×Ast )= Mst(mg)/(5,1×10(-15) ( г) ×Msam(мг)×Ast)
В этих формулах Ai – площадь пика маркера, Mst – количество введенного в пробу стандарта в мг, M sam – количество пробы, A st — площадь пика стандарта, Ri1 – доля в % маркера с индексом i в профиле ЖК определяемого микроба с номером 1 (N1), q2 – коэффициент, равный 5,1 × 10(-15) г. При этом предполагается, что г микробной биомассы содержит 5,9 × 1012 клеток бактерий, а содержание ЖК в клетке равно в среднем трем процентам.
Соответственно, число клеток любого следующего микроорганизма можно рассчитать по аналогичной формуле N2 = Ai × k / Ri2 и так далее, умножая площади пика Ai маркера, по которому проводятся вычисления, на коэффициент k и деля на содержание маркера (в %) в составе ЖК этого микроорганизма. В микробном сообществе неизбежно наложение профилей жирных кислот составляющих его микроорганизмов, когда в определяемой концентрации вещества имеется вклад от двух или нескольких микробов. Суперпозицию можно разрешить путем составления для каждого целевого вещества хроматограммы уравнения вклада каждого микроорганизма, имеющего это вещество. Тогда для m веществ хроматограммы суммарной биомассы сообщества, включающего в качестве членов n родов (видов) микроорганизмов, можно составить систему из m уравнений для n неизвестных. Получится матрица, в которой каждое неизвестное есть численность одного из таксонов микробного сообщества. Система имеет практически приемлемое приближенное решение13,16, которое приведено в виде системы формул в формате таблиц EXCEL.
Лист 2 книги EXCEL – расчет по формулам имеет следующий вид:
Такое представление позволяет, кроме получения небходимых количественных данных, контролировать баланс жирных кислот как критерий правильности решения, так и оперативно регулировать систему под изменения микробного сообщества локуса, избегая необходимости составлять и решать систему в каждом случае («живые формулы»). Практически было установлено, что для расчета клинических проб любого органа или очага воспаления приведенная ниже система формул достаточно универсальна. Нюансы микробных сообществ удается учесть применением шаблонных решений для общего микроэкологического статуса (кровь, моча), генитальных секретов мужчин и женщин, слюны, ликвора, кожи.
Лист 3 — Конечный результат в сопоставлении с нормой.

Лист 4 — Конечный результат в виде диаграммы дисбиоза.

Вертикальная линия сетки с координатой «0» — норма. Отклонеие в плюсовую сторону — избыточный рост микроорганизмов, в минусовую сторону — дефицит.
Количественные изменения некоторых микробных маркеров при заболеваниях различной этиологии показаны на хроматограммах (Рис. 12 — 14).

Рис. 12. Концентрация маркера сем. Enterobacteriacea – β-оксимиристиновой кислоты (h14) – время по шкале абсцисс 16,02 мин – при заболевании (верхняя хроматограмма) по сравнению с нормой (нижняя хроматограмма). Вагинальная жидкость.

Рис 13. Маркер анаэробного пептострептококка – изо-миристиновая кислота, i14 (время выхода 11,23). Его концентрация возросла в 50 раз у больного по сравнению с уровнем нормы (нижняя кривая; большой пик справа – миристиновая кислота фона). Вагинальная жидкость.
- Верификация метода
В пользу микробного происхождения жирных кислот, альдегидов и стеринов, не характерных для клеток организма человека, свидетельствуют следующие соображения и факты.
- Хорошо известно, что в клетках млекопитающих отсутствуют гидрокси, циклопропановые и ненасыщенные ЖК
- В результате проведенных нами анализов (несколько тысяч) биологических жидкостей человека и животных было определено, что динамичное изменение состава минорных ЖК свидетельствует об их экзогенном происхождении
- Состав ЖК макроорганизма колеблется в пределах 25% от их среднего значения в разных пробах, а состав микробных маркеров от 0 до максимума в тяжелых случаях воспаления
- При проведении этиотропной антибактериальной терапии значения минорных компонентов в крови возвращались к нормальным
- Концентрация микробного маркера коррелирует с активностью воспалительного процесса (3-гидрокси-пальмитиновая кислота в крови как маркер Brucella в случае экспериментального бруцеллеза у морских свинок, 72 дневный курс)12
- Концентрация микробных маркеров Salmonella в крови пациентов с сальмонеллезом кореллирует со значениями титров антител12
- Концентрация 10-гидроксистеариновой кислоты (маркер Сlostridium perfringens) пациентов с синдромом длительного сдавливания и диагнозом “газовая гангрена” коррелирует с наличием и количеством С.perfringens, подтвержденным культуральным методом6
- Наконец, клинические наблюдения показывают нормализацию микроэкологического статуса организма человека и подавление инфекции в результате лечебных мероприятий по данным масс-спектрометрии микробных маркеров.
В качестве примера, подтверждающего специфичность маркера приведем результаты поиска маркеров С.perfringens при газовой гангрене6 (табл. 3).
Таблица 3
Сопоставление клинических, бактериологических и ГХ-МС данных диагностики клостридиальной инфекции в сравнении с контрольными
| № | Фамилия, № и.б. | Клинический диагноз | Бактериологич. данные | Концентрация* 10-оксикислот | Летучие кислоты | |
| 18:0 | 18:1 | |||||
| 1. | Г-н, 5229 | Анаэробная клостридиальная флегмона | C.perfringens | 2,4 | 0,0 | масляная |
| 2. | М-н, 5288 | Газовая гангрена | C.perfringens | 5,4 | 0,2 | пропионовая масляная капроновая |
| 3. | М-н, 5272 | Газовая гангрена | Клостридии | 7,8 | 0,0 | масляная валериановая капроновая |
| 4. | П-н, 5248 | Анаэробная клостридиальная флегмона | Клостридии | 5,6 | 6,2 | пропионовая изомасляная масляная |
| 5. | Т-н, 5261 | Анаэробная флегмона | Клостридии | 22,1 | 2,0 | масляная валериановая |
| 6. | Г-н, 5234 | Костная посттравматическая рана | Стафилококк | 0 | 0 | масляная энантовая |
| 7. | О-ва, 5256 | Анаэробная неклостридиальная флегмона | Энтерококк, синегнойная палочка, протей | 0 | 0 | отсутствие |
| 8. | Здоровая ткань | Послеоперационный материал ткани бедра | Не инфицирована | 0 | 0 | отсутствие |
| 9. | Б. | Пептококковая инфекция | Пептококк | 0 | 0 | уксусная пропионовая масляная изовалериановая |
Экспериментальные данные показывают, что 10-оксикислоты С18 появляются лишь у тех пациентов, у которых бактериологический анализ обнаруживает присутствие клостридий, а клиническая картина соответствует газовой гангрене. В здоровых тканях, а также в тканях с неклостридиальной анаэробной инфекцией эти кислоты отсутсвуют. Все изученные виды клостридий при инфицировании животных вырабатывают 10-оксидекановые кислоты, но вид C.perfringens в несколько раз более активен.
Проведено также тестирование метода масс — спектрометрии микробных маркеров по фекалиям, поскольку микробиота фекалий подробно изучена7,8,69,70. Лидирующим в количественном отношении, по нашим данным, оказался род Eubacterium. Далее по ранжиру следуют клостридии, бактероиды, лактобациллы и бифидобактерии. Их доля составляет 84-94% от суммы по данным МСММ. Аэробы представлены в основном кокками разных таксонов, аэробными актиномицетами (актинобактериями) и микроскопическими грибами. Энтеробактерии, псевдомонады, другие грамотрицательные аэробы и вирусы присутствуют в минорных концентрациях. Данные по микробному сообществу фекалий получены у практически здоровых людей разного пола и возраста. Оказалось, что количественный состав микроорганизмов и их сумма резко индивидуально различны. Вариации по сумме составляют порядок, а по отдельным микробам до двух порядков и более. Например, разница на порядок по бифидобактериям, на два порядка по лактобациллам, на три порядка по пропионовым бактериям, хеликобактеру и Clostridium ramosum. Результат еще раз свидетельствует о нестабильности состава фекалий и, следовательно, проблематичности его использования для оценки изменений микробиоты кишечника: колебания в норме перекрывают патологические сдвиги. Сам факт существования этих микроорганизмов в составе фекалий известен, но из отдельных измерений в разных лабораториях, а также обобщений в руководствах. Данные МСММ подтверждают известные, но сразу по всем микроорганизмам фекалий в одном анализе и с большой точностью по сравнению с культуральным и, пожалуй, генетическим (FISH) методами (табл. 5).
Таблица 5
Сопоставление данных анализа микробиоты фекалий генетическим, культурально-биохимическим и масс-спектрометрическим методами.
| Состав микробиоты фекалий взрослых людей, клеток/г мокрого веса | |||||
| Масс-спектрометрия | Генетический метод, Harmsen, 2002 | Культуральный метод | |||
| Бондаренко, 2003 | Маянский (Schaechter) | Фирма Hoechst | |||
| Общая численность | 0,6-5´ 1011 | 3,5 ´ 1010 | 1010— 1011 | 1010— 1012 | 2 × 1011 |
| Доля анаэробов, % | 84-94 | До 100 | 90-95 | До 100 | 33-100 |
| Eubacterium | 1011 | 7,1 ×109 | 109 – 1010 | 109 – 1012 | 3 × 1010 |
| Бактероиды | 1010 | 9,5 ×109 | 109 — 1010 | 1010 — 1012 | 1011 |
| Клостридии | 6 × 1010 | 7,9 ×109 | 105 — 108 | 105 — 1011 | 3 × 1010 |
| Бифидобактерии | 1010 | 1.7 ×109 | 109 — 1010 | 108 — 1012 | 2 × 108 |
Полученная методом ГХ-МС общая численность микроорганизмов фекалий находится в пределах интервала значений 0,6-5´ 1011 кл/г, что согласуется с известными литературными данными измерений генетическим и культурально-биохимическим методами. Совпадает с известными оценками и относительное количество анаэробов в них, которое по этим данным составляет 88%. Родовое распределение трудно сравнивать с литературными данными, так как в них приводится очень широкий диапазон значений, в пределах трех-шести порядков. Тем не менее, совпадает оценка о приоритете рода Eubacterium, численность которых имеет порядок 1011 кл/г (109 – 1012 по литературным данным), о количестве бактероидов 1010 кл/г (1010 — 1012 по известным данным), клостридий — 6 х 1010 кл/г (105 — 1011 соответственно), бифидобактерий 1010 кл/г (1010 — 1012), а также по энтерококкам, энтеробактериям, лактобациллам и стафилококкам. Этот результат позволяет утверждать что анализ микробиоты фекалий методом ГХ-МС по жирным кислотам клеточной стенки микрорганизмов дает достоверные данные об их численности. Следовательно, можно считать так же достоверными результаты измерений численности микроорганизмов в биоптатах кишечной стенки и других клинических пробах.
Результаты разных исследований микробиоты фекалий отводят бифидобактериям в их составе почти от 100% до 0,1%. Диапазон в три порядка вряд ли вызван межлабораторной воспроизводимостью — в каждом исследовании приводится серьезная статистика и добросовестная аналитическая процедура. Разницу следует, скорее, отнести к особенностям самого материала и точностью сопоставляемых методов количественных измерений. Не вдаваясь в детали, можно заключить, что эффект доминирования бифидобактерий создает рутинная практика анализа только бифидобактерий, иногда лактобацилл, еще реже — клостридий и бактероидов в сопоставлении с долей условно-патогенной микрофлоры при исследованиях дисбактериозов. Как видно из поля зрения микробиолога при этом выпадают эубактерии, бактероиды и клостридии, которых в фекалиях по современным оценкам по крайней мере в несколько раз больше, чем бифидобактерий. Это заблуждение выглядит естественным, если вспомнить, что в рамках общей микробиологии принято считать, что в микробном сообществе в среднем культивируемыми являются не более 20% микроорганизмов любого местообитания. Что касается фекалий, то по оценкам молекулярно-генетическими методами так же оказывается, что определение 60-80% их микробиоценоза не доступно для культуральных методов исследования. Данные масс-спектрометрии коррелируют с генетическими (в рамках сопоставимости микробиологических количественных измерений) и одинаково показывают, что эубактерий, бактероидов и клостридий вместе и по отдельности на порядок больше, чем бифидобактерий.
- VI. Клинические приложения метода
- Кишечник
При ГХ-МС исследовании фракций ЖК в биоптатах кишечной стенки и пробах крови практически здоровых людей и пациентов с дисбактериозами найдено, что основными компонентами (на уровне относительного содержания более 1%) являются четные кислоты с 12 — 18 атомами углерода: С18:1, С16:0, С18:2, С18:0, С16:1 (в порядке уменьшения содержания в профиле ЖК), а также полиненасыщенные ЖК С20:n, С22:n, холестерин, альдегиды и 2-оксикислоты. Иногда величину 1% превышает содержание длинноцепочечных кислот С20 — С26. Нечетные кислоты — С15:0 и С17:0 составляют около 1% каждая.
Перечисленные выше вещества являются липидными компонентами клеток организма человека и составляют естественный фон, на котором в исследованных пробах выявлены минорные компоненты, не характерные для макроорганизма. Хроматограммы, полученные по методу селективных ионов, позволяют уверенно детектировать микробные компоненты на фоне преобладающих компонентов слизистой кишечника (рис 1).
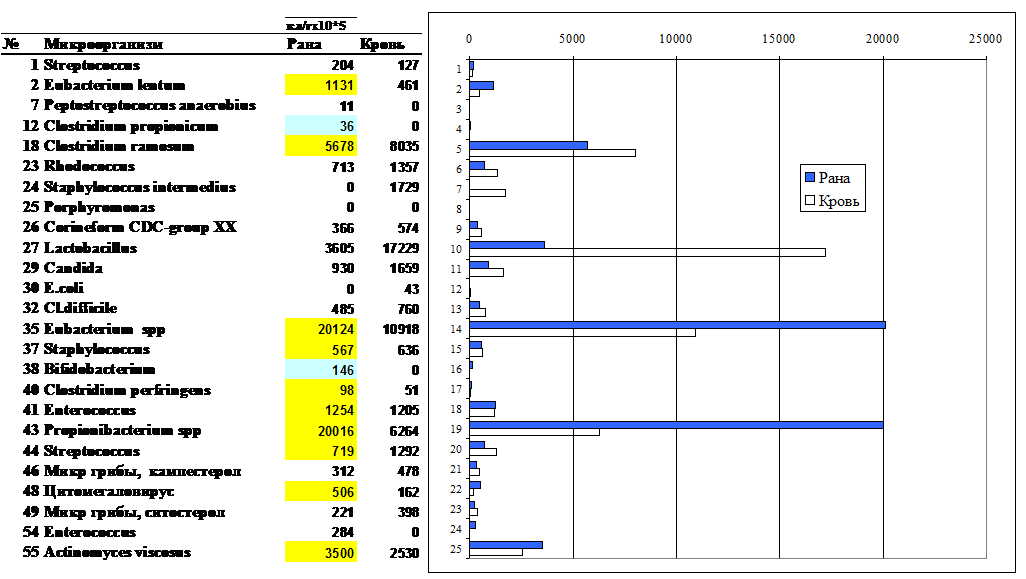
Концентрация микробных маркеров, следовательно, и соответствующих им микроорганизмов пристеночного слоя кишечника (табл. 5, Рис 14 – круговая диаграмма таксонов) в биоптатах кишечной стенки здоровых людей по порядку величины оказалась одинаковой для тощей, подвздошной и толстой кишок (0,6 — 1) ´ 1011 кл/г, но существенно меньшей по сравнению с фекалиями (2,7´ 1011 кл/г)71. По данным табл. 5 общая удельная численность микроорганизмов в пристеночном слое ободочной кишки в два с половиной раза меньше, чем в фекалиях, но доля анаэробов также составляет 89%. Однако родовой состав внутри группы анаэробов иной, чем в фекалиях. На стенке больше втрое концентрация бифидобактерий, но меньше лактобацилл и эубактерий. Причем у последних изменен и видовой состав по сравнению с фекальным. Интересно отметить, что концентрация C. perfringens на три порядка меньше в пристеночном слое как ободочной, так и подвздошной кишки, чем в фекалиях, но снова увеличивается в тощей. Это означает практически, что фекалии являются основным местообитанием этих бактерий, а также С. propionicum. Другие клостридии, C. hystolyticum и C. difficile сохраняют порядок величины по отделам кишечника и в фекалиях (около 103), а C.ramosum не обнаруживается в фекалиях, но ее численность раcтет от 108 в ободочной до 109 в тощей кишке. Следующей по численности группой в фекалиях являются факультативные анаэробы – энтеробактерии и энтерококки, в основном, за счет E.faecalis, который не обнаруживается в подвздошной и тощей кишках, тогда как прочие энтерококки, хеликобактер и клебсиеллы равномерно заселяют кишечник и фекалии. E.coli и другие бактерии сем. Enterobacteriaceae в норме обнаруживаются методом ГХ-МС только в кишечной стенке, а Campylobacter mucosalis – только в фекалиях.
Таблица 5.
Состав микроорганизмов стенки кишечника и в фекалиях по группам
| Группы и таксоны микроорганизмов | Численность, кл/г ´106 | |||
| Тощая | Подвздошная | Ободочная | Фекалии | |
| Кокки, бациллы, коринебактерии | ||||
| Streptococcus (Lactococcus) | 261 | 253 | 1170 | 1691 |
| Bacillus cereus | 0 | 51 | 157 | 284 |
| Bacillus megaterium | 90 | 0 | 0 | 0 |
| Corineform(Listeria) а17 | 1398 | 439 | 713 | 65 |
| Staphylococcus | 616 | 410 | 490 | 121 |
| Streptococcus (оральные) | 1642 | 127 | 2 | 641 |
| Сумма | 4006 | 1281 | 2533 | 2803 |
| Анаэробы | ||||
| Eubacterium lentum | 98 | 675 | 670 | 4334 |
| Clostridium hystolyticum | 692 | 467 | 849 | 388 |
| Peptostreptococcus anaerobius | 487 | 330 | 423 | 37 |
| Clostridium propionicum | 1237 | 150 | 0 | 13942 |
| Bacteroides hypermegas | 0 | 0 | 0 | 163 |
| Clostridium ramosum | 3892 | 1942 | 118 | 0 |
| Fusobacterium | 0 | 0 | 0 | 129 |
| Porphyromonas | 0 | 0 | 0 | 39 |
| Lactobacillus | 17355 | 17190 | 16231 | 30510 |
| Eubacterium moniliforme | 0 | 0 | 0 | 892 |
| Cl.difficile | 1769 | 861 | 1055 | 684 |
| Prevotella | 620 | 583 | 345 | 7557 |
| Eubacterium (основная группа) | 6832 | 11497 | 24457 | 12026 |
| Bacteroides fragilis | 0 | 63 | 43 | 1340 |
| Bifidobacterium | 5249 | 7108 | 31886 | 10723 |
| Clostridium perfringens | 224 | 50 | 43 | 44698 |
| Eubacterium | 27 | 1548 | 3549 | 93218 |
| Propionibacterium (P.freudenreichii) | 12777 | 1057 | 13086 | 3648 |
| Propionibacterium acnes | 0 | 0 | 359 | 388 |
| Ruminicoccus | 804 | 800 | 1364 | 30 |
| E.lentum 7741 | 93 | 56 | 0 | 282 |
| Bacteroides ruminicola | 0 | 7 | 9 | 2769 |
| Eubacterium spp. | 365 | 265 | 5650 | 9725 |
| Propionibacterium | 0 | 0 | 0 | 698 |
| Сумма | 52520 | 44648 | 100138 | 238219 |
| Аэробные актиномицеты | ||||
| Nocardia sp. | 1595 | 0 | 1136 | 7 |
| Актиномицеты | 797 | 289 | 105 | 0 |
| Pseudonocardia | 215 | 7 | 85 | 34 |
| Streptomyces | 493 | 392 | 329 | 1522 |
| Rhodococcus | 1588 | 792 | 698 | 127 |
| Mycobacterium/Candida | 3025 | 3184 | 3257 | 0 |
| Actinomadura | 151 | 0 | 12 | 0 |
| Nocardia asteroides | 1782 | 0 | 609 | 108 |
| Actinomycetes 10Me14 | 3652 | 3196 | 2328 | 92 |
| Сумма | 13297 | 7859 | 8558 | 1891 |
| Грам (-) палочки | ||||
| Acinetobacter | 0 | 0 | 0 | 125 |
| Pseudomonas aeruginosa | 0 | 0 | 0 | 42 |
| Stenotrophomonas maltophilia | 0 | 0 | 0 | 24 |
| Сумма | 0 | 0 | 0 | 191 |
| Энтеробактерии и энтерококки | ||||
| Alcaligenes | 146 | 261 | 190 | 84 |
| Campylobacter mucosalis | 0 | 0 | 0 | 18 |
| E.coli | 20 | 21 | 25 | 0 |
| Helicobacter pylory | 529 | 141 | 92 | 2134 |
| Enterococcus | 783 | 484 | 1252 | 669 |
| Enterococcus faecalis | 0 | 0 | 530 | 4649 |
| Сумма | 1478 | 907 | 2089 | 7554 |
| Микроскопические грибы | ||||
| Микромицеты (кампестерол) | 216 | 375 | 112 | 1430 |
| Микромицеты (ситостерол) | 197 | 422 | 56 | 888 |
| Микромицеты (эргостерол) | 0 | 0 | 0 | 286 |
| Сумма | 413 | 797 | 168 | 2604 |
| Вирусы | ||||
| Герпес | 216 | 113 | 203 | 0 |
| Цитомегаловирус | 919 | 31 | 26 | 8 |
| Сумма | 1135 | 144 | 230 | 8 |
| Не идентифицированы | ||||
| Маркер i14 | 0 | 840 | 92 | 15192 |
| Маркер i17 | 3066 | 1549 | 0 | 2061 |
| Сумма | 3066 | 2389 | 92 | 17253 |
| Общая сумма | 75915 | 57772 | 112637 | 270523 |
Существенную долю (17%, 1,3 × 1010 кл/г) микробиоты тощей кишки (в фекалиях – на порядок меньше) составляют аэробные актиномицеты (актинобактерии – по современной классификации микроорганизмов). В специализированных лабораториях подтверждено их наличие на слизистых оболочках и коже человека и животных, а также их участие в воспалительных процессах. Они не доступны рутинному клиническому контролю, однако, благодаря наличию уникальных молекулярных маркеров, могут быть обнаружены и количественно измерены методом масс-спектрометрии. Далее по численности следуют аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии) – около 5% в тощей кишке и 1% в фекалиях.
В результате удалось измерить концентрацию микробных компонентов непосредственно в месте обитания, где присутствуют сами клетки микробов кишечной стенки. Поэтому мы вправе делать прямые доступные нам сопоставления между концентрацией маркеров и числом микробных клеток в условиях отсутствия пищевой липидной компоненты, поскольку биоптаты получали натощак. Такая логика убеждает в том, что измерена ведущая микробиота кишечной стенки. Ведущая в количественном отношении, так как оказалось, что при наличии биоптата весом 4 мг можно детектировать микроорганизмы начиная с концентрации 104 — 105 кл/г, поэтому, значительная часть минорных микроорганизмов кишечника осталась вне поля зрения. Как оказалось, общая численность микроорганизмов кишечной стенки в норме имеет величину в пределах (0,5-1,3)×1011 кл/г в зависимости от отдела кишечника (табл. 5).
Плотность заселения стенки кишечника в дистальном направлении меняется мало: в подвздошной кишке она в два раза меньше, а в толстой в полтора раза больше, чем в тощей. Пристеночная микробиота оказалась существенно более концентрированной, чем просветная (по литературным данным69), которая в тонкой кишке на шесть порядков ниже по численности (до 105 кл/мл), в подвздошной кишке – на порядок выше, а в ободочной кишке соответствует таковой в ее содержимом. Видовой состав микроорганизмов соответствует известным представлениям о компонентах кишечной микробиоты, в особенности – микроорганизмов фекалий70. Однако сходство ограничивается категориями общего характера: качественного состава и приоритетного (рангового) содержания основных элементов кишечного микробиоценоза. Действительно, в толстом кишечнике и фекалиях существенно больше анаэробов.
Основную долю (от 70% в тощей кишке до 88% в фекалиях) микроорганизмов во всех отделах кишечника составляют анаэробы. Второе место по численности в тощей кишке занимают актиномицеты – 17% (в фекалиях их всего 0,7 %). Аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии) – составляют 5% колонизации тонкого кишечника по сравнению с 0,7 % в фекалиях. Доля энтеробактерий и энтерококков по отделам кишечника и в фекалиях близка к 2%.
Неожиданным результатом, несомненно, является обнаружение значительного количества аэробных актиномицетов. Специфичность их маркеров — разветвленных жирных кислот с метильной группой в положении Δ10 не позволяет предполагать какие-либо иные таксономические группы микроорганизмов, кроме представителей порядка Actinomycetales, содержащих в составе клеточной стенки миколовые кислоты, которые являются источником 10Ме-разветвленных ЖК. Они содержатся в микобактериях, нокардиях, родокках, Actinomadura spp. и других актиномицетах, но не найдены у высших организмов (в грибах, растениях, животных). Присутствие этих молекул в биоптатах кишечника, крови и других органах и жидкостях человека подтверждается масс-спектрами в хроматографическом пике и относительным хроматографическим временем удерживания, а также их анализом в составе музейных культур соответствующих микроорганизмов. Бактерии родов Streptomyces и Nocardiopsis подтверждены также уникальным маркером изо-гексадекановой кислотой (i16). Кроме того, профиль разветвленных ЖК, специфичных для стрептомицетов, выявлен в крови септических больных72, а Nocardiopsis dassonvilley выделен в чистой культуре из кишечника71. Список актиномицетов, на самом деле, шире, чем это показано в первой группе табл. 5. Сюда следует добавить анаэробные актиномицеты и близкие к ним микроорганизмы. Это Propionibacterium, Actinomyces, Brevibacterium, которые также выделены в чистой культуре и коринеформные бактерии. Наконец, если учесть, что до настоящего времени в некоторых руководствах по микробиологии, как и ранее73, род Bifidobacterium относят к семейству Actinomycetaceae, то окажется, что актиномицеты филогенетически близки к традиционно известным представителям пристеночной микробиоты кишечника. С ними возрастает значимость микробиоты кишечника для организма хозяина, так как актиномицеты превосходят все прочие микроорганизмы по продукции антибиотиков и витаминов и обладают мощным ферментативным аппаратом. Высокая степень колонизации кишечника актиномицетами не выглядит необычным явлением, если иметь в виду, что они широко распространены в окружающей среде – почве, воде, воздухе, на внутренних стенах жилых и производственных помещений74. Их обитание в организме человека при таких обстоятельствах выглядит естественным. Действительно, в руководствах по клинической микробиологии отмечается обнаружение актиномицетов и родственных организмов, таких как Mycobacterium, Actinomadura, Propionibacterium, Actinomyces, Corynebacterium, Bifidobacterium в кишечнике и других органах человека. Они известны (в том числе и бифидобактерии) как участники инфекционных и воспалительных процессов. Однако патогенность актиномицетов, чувствительность к антибиотикам, способы лечения связанных с ними заболеваний являются предметом единичных специализированных лабораторий и клиник. Трудности в их бактериальной диагностике и культивировании послужили препятствием широкой известности этих микроорганизмов в клинической практике, в том числе, при многочисленных заболеваниях, связанных с изменением микробиоты кишечника.
Итак, применение масс-спектрометрического метода дало возможность измерить численность более 50 таксонов микроорганизмов кишечника не только в фекалиях, но и в отделах самого кишечника, путем анализа их маркеров (ЖК) непосредственно в биоптатах, полученных при интестиноскопии и колоноскопии с ретроградной илеоскопией. Эти данные показывают, что там также доминируют эубактерии, а их видовой состав существенно меняется по длине кишечника. Следует отметить филогенетическое родство эубактерий и клостридий. В определителе Берджи 9-го издания прямо сказано, что род Eubacterium создан для удобства, чтобы поместить в него слабо спорообразующие клостридии. Если отметить еще известную, и до сих пор не упорядоченную, гетерогенность обеих родов, то можно видеть, что кишечная микробиота представляет собой доминирующий континуум штаммов и видов родов Clostridium и Eubacterium в их современном написании при равновеликом суммарном количестве бифидобактерий, пропионобактерий и лактобацилл. На долю остального биоразнообразия микроорганизмов кишечника (по данным масс-спектрометрии) приходится до 10% в фекалиях и пристеночном слое ободочной кишки и до 30% в тощей кишке. О том, что роды клостридий и эубактерий близки генетически, свидетельствует отсутствие на сегодня специфичных зондов для каждого рода. Зонды, сконструированные для клостридий перекрестно определяют эубактерии и наоборот. Например, зонд, предложенный для определения группы новых клостридий во главе с C.coccoides (обнаружен в кишечнике в 1997г) включает в группу кроме эубактерий еще и руминококки.

Рис. 14. Состав доминантных родов и групп микроорганизмов из микробоценоза жителей г.Москвы. Измерено по микробным маркерам в биоптатах тощей кишки.

Рис. 15. Состав доминантных родов и групп микроорганизмов из микробоценоза жителей г.Москвы. Измерено по микробным маркерам в крови.
Обнаруженный в результате систематических исследований гомеостаз микробных маркеров в крови75,76 и адекватность его профиля составу кишечной микробиоты здорового человека (рис. 15) обеспечил уникальную возможность мониторировать состояние микробиоты кишечника неинвазивным экспрессным методом – по анализу крови71. Поскольку в кровь попадают также липидные компоненты отмирающих микроорганизмов из других органов, то его можно считать экспрессным методом определения микроэкологического статуса высших организмов.
- Нозологическая специфичность дисбактериоза кишечника
Наблюдение за микробиотой тонкого кишечника при четырех кожных заболеваниях – себорея, акне, атопический дерматит, алопеция дает подтверждение предположению Шендерова Б.А. о том, что «Существует столько вариантов дисбаланса микробиоценозов человека, сколько известно нозологических форм заболеваний», то есть о нозологической специфичности дисбактериоза кишечника77. Увидеть это помогает графичесое сопоставление дисбактериоза при упомянутых заболеваниях и при синдроме раздраженного кишечника для дополнительного сравнения (рис 16-19 )40.

Рис 16. Себорея. У больных себорейным дерматитом при дефиците лактобацилл и пропионобактерий в кишечнике высока концентрация маркеров клостридий группы C.ramosum и видов Eubacterium

Рис 17. Угревая болезнь. При угревой болезни (акне) наблюдается дефицит лактобацилл при избыточном росте клостридий группы C.ramosum, бифидобактерий, вирусов герпеса и других микроорганизмов

Рис 18. Атопический дерматит. При атопическом дерматите в кишечнике регулярно обнаруживается дефицит бифидобактерий при избыточном росте видов Eubacterium, Propinibacterium freudenreichii, нокардий и других микроорганизмов
При атопическом дерматите в микробиоте пристеночного слоя кишечника (посредством измерения микробных маркеров в крови) обнаружили дефицит бифидобактерий при избыточном росте видов Eubacterium, Propinibacterium freudenreichii, нокардий и других микроорганизмов.

Рис 19. При синдроме раздраженного кишечника наблюдается тотальный дефицит кишечной микробиоты до семикратного снижения общей численности микроорганизмов при избыточном росте эубактерий и стрептококков.
Метод масс-спектрометрии микробных маркеров, благодаря своей экспрессности и информативности, позволил получить экспериментальные данные, подтверждающие связь ряда заболеваний с изменением микроэкологического статуса организма. Эти данные согласуются с известными данными о связи микробиоты кишечника с кожными заболеваниями78. Более того, они позволяют узнать существо изменений микробиоты, причем, именно тонкого кишечника, а не фекалий, как это делалось в предыдущих исследованиях. Для практического врача это означает возможность усовершенствования тактики лечения больных за счет выбора этиотропных антибиотиков для подавления избыточного роста (инфекции) части микробиоты и стимулирования размножения дефицитной группы микробов.
- Реабилитация
Одним из последствий стрессовых воздействий на организм человека является нарушение, порой устойчивое, обмена веществ в организме как следствие изменений микрофлоры кишечника и ассоциированной с ними проницаемости кишечной стенки. В результате возникает диспропорция в поступлении биологически активных веществ, продуцируемых микроорганизмами, в организм хозяина и нарушение нормального функционирования его органов. Последствия могут быть патологическими, поскольку от микробиоты кишечной стенки зависит продукция более половины необходимых для человека витаминов, ферментов, факторов, сигнальных молекул, медиаторов и других гормоноподобных соединений, требуемых для обеспечения метаболизма и репродукции его собственных клеток и систем – иммунной, нервной, эндокринной и других. Пептидогликан клеточных стенок грамположительных микроорганизмов (они составляют абсолютное большинство пристеночной микробиоты кишечника человека) активно участвует в регуляции иммунного статуса хозяина на местном и системном уровнях. Считается, что именно микроэкологические изменения в организме хозяина являются запускающим механизмом подавляющего большинства патологических процессов77.
Поэтому микроэкологический статус человека, точнее, поддержание его гомеостаза, является необходимым условием стабильного функционирования всех его органов и систем. Соответственно, одним из первых этапов в реабилитации людей, переживающих экстремальные ситуации в силу особенностей своих профессий (бойцы горячих точек, эвакуаторы, ликвидаторы аварий и другие), должен быть контроль и восстановление микробиоценоза, если он оказался нарушенным.
На рубеже ХХI века сформировалось представление о микрофлоре организма человека как о еще одном «органе», покрывающим в виде «чулка» кишечную стенку, другие слизистые оболочки и кожу человека. Оставаясь невидимым, этот «орган» весит около двух килограммов и насчитывает порядка 1014 клеток (сто биллионов) клеток микроорганизмов. Это число в десять раз превышает число собственных клеток организма-хозяина71,77.
При обследовании пациентов с подозрениями на изменение микроэкологического статуса (кишечные или кожные проблемы, аллергия, сепсис, лихорадка неясного генеза и прочее) выявлены следующие типы изменений нормальной микробиоты организма пациентов.
- Избыточный рост микроорганизмов, общий или частичный
- Тотальный дефицит
- Разнополярные изменения отдельных составляющих микробиоты
- Появление нехарактерных для нормы групп микроорганизмов
Эти изменения соответственно адекватны изменению пула химических веществ, поступающих к хозяину от микробиоты.
Типовой вид результатов обследования на микроэкологический статус методом масс-спектрометрии микробных маркеров показан на рис. 20.

Рис.20. Сепсис у больной А (проба NT-530). Доминируют маркеры Clostridium ramosum и лактобацилл при дефиците пропионобактерий, бифидобактерий и других микроорганизмов нормальной микробиоты. Клинически значимый уровень превышают маркеры дрожжей кандида, стрептококков, руминококков, бактерий сем. Enterobacteriaceae (E. coli), актинобактерий Rhodococcus, Streptomyces, Nocardia asteroides и Eubacterium lentum.
- Синдром раздраженной кишки
При синдроме раздраженного кишечника наблюдается тотальный дефицит кишечной микробиоты до семикратного снижения общей численности микроорганизмов преимущественно за счет уменьшения численности лактобацилл, бифидобактерий, основной группы эубактерий и пропионобактерий при избыточном росте эубактерий и стрептококков.71. Кроме того, растет численность анаэробов Bacteroides fragilis, Porphyromonas, Propinobacterium acnes, при периодическом избытке энтеробактерий, клостридий группы C. ramosum и Eggertella lenta, а также Campylobacter mucosalis, энтерококков, псевдомонад, Acinetobacter, бацилл и стрептококков. Эта группа микробов, вероятно, является источником токсинов, поддерживающих заболевание при дефиците противодействия со стороны основных представителей нормальной микробиоты. В переводе на общепринятый язык ее можно определить как группу условно-патогенных микроорганизмов. В таком случае разумно говорить об антибиотикотерапии при СРК, хотя это выглядит на первый взгляд абсурдным. В действительности, назначение полусинтетических пенициллинов и сульфамиламидов параллельно с сухими пробиотиками оказывается эффективным. Однако выборочные контрольные анализы (метод МСММ эффективен в мониторинге и коррекции лечебных мероприятий) после лечения показывают, что микробиота кишечника восстанавливается лишь на 50%. Добавление в терапию метронидазола, повышает эффект. Эффективность пары амоксициллин-метронидазол отмечена при избыточном росте анаэробных бактерий (эубактерии, пропионобактерии, клостридии и другие). В пяти клинических случаев было показано, что монотерапия метронидазолом стимулирует рост нормальной микробиоты тонкого кишечника. Прием этого препарата в течение времени и доз, указанных в аннотации, не показал по данным ГХ-МС анализа угнетения остальной части полезной микробиоты кишечника.
- Муковисцидоз
Работа по определению состава микроорганизмов в мокроте больных муковисцидозом проведена в отделении муковисцидоза Российской детской клинической больницы (80 пациентов). Это исследование, задуманное с целью выявления анаэробной составляющей в мокроте пациентов, показало, что наряду с традиционно известными агентами муковисцидоза – псевдомонадами, стафилококками и другими микроорганизмами в мокроте обнаруживаются маркеры анаэробов родов Сlostridium, Eubacterium, Propionibacterium, Actinomyces и других, причем, анаэробы доминируют в микст-инфекции.
- Пиелонефрит
Проведена реконструкция микст-инфекции при пиелонефрите по микробным маркерам в моче детей Детской городской клинической больницы № 13 им. Н.Ф.Филатова (Москва, 60 пациентов). В ходе исследования было показано, что в моче доминируют маркеры анаэробов Propionibacterium freudenreichii, клостридий Clostridium hystolyticum, C. rhamosum и С. propionicum, специфичных для кишечника, и значительно повышена концентрация маркеров Alcaligenes, Pseudomonas aeruginosa и Moraxella. Кишечные микробы создают мукус повышенной (в присутствии P. freudenreichii) вязкости, способствующий размножению многочисленных видов микроорганизмов и физически препятствующий обменным процессам.

- Сепсис и инфекция в области хирургического вмешательства
При септических состояниях, лихорадках, как правило, неясного генеза, чаще происходит избыточный рост ряда микроорганизмов из состава нормальной микробиоты хозяина, что по определению является инфекцией79. Общим признаком этой части пациентов является более чем двукратное превышение в крови концентраций маркеров стафилококков, клостридий группы Clostridium ramosum, энтерококков, лактобацилл, Eubacterium lentum (Eggertella lenta) и дрожжей кандида. Наибольший прирост численности бактерий приходится на C. ramosum и лактобациллы. К частным признакам относится прирост численности основной группы эубактерий (Eubacterium moniliforme, E.nodatum, E.sabureum), который наблюдается не у всех пациентов. Частично участвуют в инфекционном процессе грамотрицательные микроорганизмы сем. Enterobacteriaceae (E. сoli, Proteus, Klebsiella и другие). Реже уровень клинической значимости превышали маркеры псевдомонад, моракселл, Fusobacterium/Haemophylus, Selenomonas, Helicobacter pylori и Prevotella. Другие грамотрицательные бактерии, такие как представители родов Stenotrophomonas, Acinetobacter, Neisseria, Bacteroides, Burkholderia, Francisella не превышали уровня клинической значимости или предела детектирования. У больных с раневой инфекцией или сепсисом наблюдали общий избыточный рост микробиоты по оценке микроэкологического статуса, при том обстоятельстве, что численность части микроорганизмов почти у всех обследованных снижалась более чем в два раза по сравнению с нормой. Это относится, прежде всего, к бифидобактериям, пропионобактериям, энтерококкам и Clostridium propionicum. В некоторых случаях значимые снижения концентраций отмечены для лактобацилл, эубактерий, коринебактерий и микроскопических грибов (не из рода кандида).
Что касается инфекционной составляющей, то она, как и следовало ожидать, наилучшим образом выявляется при анализе материала из очага инфекции: соскоба, пунктата, экссудата. Если очаг закрыт, то информацию можно получить и из анализа крови. Сопоставление результатов двойного анализа – раневого экссудата и крови — для больного с инфекцией в области хирургического вмешательства после удаления селезенки представлено на рис 21.
Рис. 21. Сопоставление результатов двойного анализа – раневого экссудата и крови — для больного с инфекцией в области хирургического вмешательства после удаления селезенки.
Как видно из рисунка, ведущими микроорганизмами (около 90% в раневом экссудате) являются анаэробы. Это клостридии C. ramosum и C. perfringens, пропионобактерии P.freudenreichii, эубактерии Eubacterium moniliforme, E.nodatum, E.sabureum, E. lentum и анаэробный актиномицет Actinomyces viscosus. Все они составляют нормальную (индигенную) микробиоту организма человека. Им сопутствует группа кокковых бактерий: стафилококки, стрептококки, энтерококки, которые обычно выявляют при классическом бактериологическом исследовании. Их доля в данном примере около 6%. Выше нормы концентрация микроскопических грибов кандида, актинобактерий Streptomyces, Nocardia, Rhodococcus и других, на долю которых приходится 7% общей инфекции. Минорную группу составляют грамотрицательные микроорганизмы: Moraxella, Pseudomonas aeruginosa, Fusobacterium, Alcaligenes и Helicobacter pylori. Маркеров бактерий сем. Enterobacteriaceae в экссудате не обнаружено (менее 105 клеток/мл).
У больного с септическим менингитом, развившимся в результате черепно-мозговой травмы, в ликворе найдено 23 таксона микроорганизмов, маркеры которых имеют клинические значимое (более чем в два раза) превышение нормы. Обнаружено, что ведущими микроорганизмами воспаления мозга являются клостридии группы C. ramosum, а также C. propionicum и C. hystolyticum. Вычисленная по концентрации их маркеров численность самих микроорганизмов в зоне ликвора составляет 9×108 клеток/мл. На втором уровне микст-инфекции представлены актинобактерии (аэробные актиномицеты) родов Rhodococcus, Pseudonocardia и не идентифицированные виды, а также Eubacterium стафилококки, пропионобактерии, дрожжи кандида и микроскопические грибы. Их уровень концентрации имеет порядок 107. На порядок ниже, но тоже с избыточным ростом обнаруживаются маркеры бактерий сем. Enterobacteriaceae, превотелл, золотистого стафилококка, клостридий перфрингенс, хеликобактера, энтерококков, стрептококков, вирусов и анаэробных актиномицетов Actinomyces viscosus. Не обнаружены (менее 105) анаэробный пептострептококк, синегнойная палочка и бактероиды.
Из экспериментальных данных следует, что измерение микробных маркеров in situ выявляет новую группу микроорганизмов из числа трудно культивируемых, и поэтому, мало известных в клинической практике. Эти участники септического или раневого инфекционного процесса — клостридии, эубактерии, лактобациллы, хеликобактеры, стрептомицеты, родококки — обладают высокой патогенетической активностью. Она известна из специфически связанных с этими организмами нозологий, каждая из которых воспринимается сама по себе как серьезное заболевание, трудно поддающееся лечению. Клостридии групп C. perfringens и C. ramosum (группа RIC – ramosum, inocuum, clostridioforme) – это гангрена, Eubacterium – септический артрит, Lactobacillus – септицемия и эндокардит, H. pylory –язвенная болезнь желудка, языка и атеросклероз; Streptomyces и другие актинобактерии — туберкулез, нокардиозы и актиномикозы. Токсигенные штаммы Streptomyces выделяют токсин валиномицин, разрушающий митохондрии клеток млекопитающих74.
- Микроэкология и физиология урогенитальных (УГТ) органов человека
Концентраций жк микробного происхождения в моче, эякуляте и вагинальном содержимом больных и здоровых людей измерена методом МСММ. Результаты статистического анализа их распределения свидетельствует о гомеостазе маркеров микроорганизмов в норме, следовательно, и соответствующего микробиоценоза локусов УГТ. Статистическая обработка данных позволила выявить два множества (кластера) значений концентраций минорных ЖК.80,81 Один из них с меньшим значением средних величин можно отнести к норме, а другой – с высоким средним уровнем – к патологии, т.е. воспалению.
а) Хронические вагиниты
В вагинальной жидкости имеется 19cyc (циклононадекановая кислота), как компонент клеток аэробных бактерий рода Lactobacillus (палочки Додерлейна), которые являются нормальными обитателями вагины. 3-гидроксикислоты в жидкостях УГТ здоровых людей отсутствуют (менее 0,01 % ) за исключением h16 и h18. В семенной жидкости обнаружены жирные альдегиды С 16 и С 18. Ряд веществ — гидроксикислоты h12, h14, h10, 2h14; циклопропановая кислота 17cyc — не обнаруживаются у доноров.
Статистический анализ, проведенный по пакету программ Statistica, показал разделение множества значений концентраций большинства минорных жирных кислот (МЖК) на два кластера, что свидетельствует в пользу их микробного происхождения80. Первый из них, более узкий, имеющий нормальное распределение, близок к уровню содержания соответствующих МЖК у доноров, по-видимому, соответствует норме. Второй кластер с широким, несимметричным распределением содержит множество значений, превышающих уровень содержания МЖК у доноров. Его следует отнести к патологическим отклонениям. Сопоставление данных анализа МЖК с клинической картиной заболевания подтверждает это предположение. Например, для пациентов с диагнозом гонорея характерно наличие 3-гидроксидодекановой кислоты (h12). При вагинитах или других воспалительных процессах наблюдается появление или увеличение по сравнению с нормой маркеров микроорганизмов, вызывающих инфекцию. Например, антеизо-кислоты — при стафилококковой аэробной инфекции; 3-гидроксидекановая, 2-гидроксилауриновая — при псевдомонадной инфекции; изомиристиновая кислота, i14- при выявлении Peptostreptococcus anaerobius; гидрокси-изо-кислоты – при инфекции видами Bacteroides. Увеличение концентрации 10-метилоктадекановой (туберкулостеариновой) кислоты обнаружено у больных туберкулезом, а увеличение в моче 3-гидроксиоктадекановой кислоты, специфичной для Helicobacter pylori, в большинстве случаев наблюдается у пациентов с гастритом или язвой желудка. Появление 3-гидрокси-изо-эйкозановой, 3-гидрокси-эйкозановой, 3-гидрокси-докозановой кислот, содержащихся в клетках Chlamydia trachomatis, характерно для пациентов с хламидиозом.
Многочисленные анализы инфекции и дисбиозов при вагинитах выявили ряд типичных случаев.
- Гонококковый вагинит. В вагинальном секрете и соскобах присутствуют маркеры Neisseria и сопутствующей в таких случаях анаэробной микрофлоры (пептострептококк, бактероиды, фузобактерии, превотелла, Selenomonas). В то же время занижено содержание лактобацилл, бифидобактерий, некоторых клостридий, руминококков, актиномицетов, части эубактерий и других микроорганизмов нормофлоры — вагинальный дисбактериоз.
- Синергизм актинобактерий и кокков. Превалируют аэробные актиномицеты (актинобактерии Streptomyces, Nocardia и др.) со стрептококками, бифидобактериями и руминококками. В числе кокков — Rhodococcus equi, который рассматривают как внутриклеточный условный патоген (аналог гонококка, но менее вирулентный — обычно встречается у мужчин при простатите). Превышают норму некоторые другие бактерии, среди которых заслуживают внимания два вида клостридий.
- Ложный кандидоз, подмена агента при молочнице. Похожую клинику дает Clostridium perfringens при отсутствии Candida albicans. Превышают норму маркеры анаэробных бактерий perfringens и Propionibacterium spp. Завышено содержание маркера Staphylococcus epidermidis.
- Энтеробактерии. Эндотоксинемия. Ведущими микроорганизмами являются грамотрицательные микроорганизмы, преимущественно сем. Enterobacteriaceae, которые создают высокие концентрации эндотоксина в локусе и в крови.
- Микоз, без участия кандиды. Существенно превышают норму маркеры микроскопических грибов, продуцирующих кампестерол и ситостерол, а также Staphylococcus aureus и клостридии Clostridium propionicum и Clostridium perfringens. Ниже нормы количество многих бактерий, в том числе бифидобактерий и лактобацилл (дисбактериоз).
- Ведущая микрофлора представлена бактериями Clostridium perfringens и микроскопическими грибами Candida albicans при наличии Streptococcus (Streptococcus oralis) и грамотрицательных микроорганизмов родов Klebsiella, а также анаэробов
- У женщин с проблемами беременности или неудачами ЭКО методом ГХ-МС выявляется существенное превышение нормы «скрытыми» (от рутинных методов) компонентами нормальной микробиоты: Clostridium perfringens, Helicobacter pylory, Streptomyces, Eubacterium. При наличии такого рода токсигеннных микроорганизмов в детородном органе как по отдельности, а тем более при одновременном присутствии, вряд ли будет возможным развитие оплодотворенной яйцеклетки в полноценный плод и нормальное протекание беременности81.
Полученные данные подтверждают современное представление об инфекциях УГТ как о полимикробном воспалении. Более того, данные показывают, что ни один из контролируемых таксонов микроорганизмов не сохраняет свою концентрацию в пределах нормы при воспалениях. Здесь понятие таксон может иметь ранг семейства или рода как правило. То есть, на самом деле видовое разнообразие микробиоценоза УГТ в несколько раз шире, в сравнении с результатами рутинных клинических обследований.. Следует отметить, что оно напоминает кишечную микробиоту своим качественным составом, в том числе анаэробами, среди которых фигурируют клостридии, бактероиды, бифидобактерии, лактобациллы, фузобактерии пептострептококки и эубактерии, обитающие в кишечнике. Такую связь отмечают авторы научных публикаций и практикующие врачи. Полученные нами данные еще раз свидетельствуют о том, что причину воспалений органов малого таза надо искать еще и в кишечнике.
Подобно микробиоте кишечника микробное сообщество слизистых половых органов женщин гомеостатично и играет положительную роль в обменных процессах и защите от внешних патогенов. В то же время оно проявляет и враждебные по отношению к хозяину функции, если состав микробиоты нарушен и токсинообразование, характерное для большинства представителей нормальной микробиоты, становится клинически значимым и может угрожать здоровью женщины. Более того, оно может угрожать и главной физиологической функции женских половых органов – репродуктивной. протекание беременности.81
б). Воспалительные процессы внутренних половых органов женщин
По данным из научной литературы, воспалительные процессы внутренних половых органов составляют 62,5% в структуре гинекологической заболеваемости, причем, у 9,5% женщин диагностируют гнойные воспалительные заболевания маточных труб и яичников.
Отмечается, что инфекционные заболевания редко вызываются одним возбудителем. Смешанные инфекции составляют примерно 20-30% в структуре инфекционных заболеваний матки и придатков, т.е. почти у каждой третьей пациентки выявляется инфекционный процесс, вызванный несколькими возбудителями. Подавляющее большинство воспалительных заболеваний органов малого таза обусловлено собственной условно-патогенной микробиотой, ведущая роль в развитии которых принадлежит наиболее вирулентным анаэробам, энтеробактериям и коккам82. В микробиоте влагалища могут присутствовать гнилостные бактерии родов Bacillus, Proteus, Clostridium, Spirochaeta. Количество анаэробов преобладает над аэробами в 10 раз в микробиоценозе вагины83. Выглядит перспективным выявление специфических веществ (маркеров микроорганизмов) и использование этих данных для реконструкции состава смешанной инфекции с помощью метода ГХ-МС. Этот метод применен для исследования инфекционной составляющей патологического процесса внутренних половых органов (цервикальный канал, матка, трубы, яичники), приводящего к необходимости оперативного решения проблемы. Исследованы 21 инфицированный биоптат от 10 пациенток перенесших операции по разным поводам79. Из 54 таксонов микроорганизмов, контролируемых в процессе анализа, 32 показывают избыточный рост (инфекцию). Инфицирование каждого исследованного материала включает несколько (до двенадцати) таксонов микроорганизмов. Это подтверждает тезис о смешанном характере инфекции половых органов женщин. Полученные данные подтверждают также сформировавшееся представление о доминировании анаэробов. Их доля составляет 70-90% по нашим измерениям и соответствует оценке других авторов. В отличие от предыдущих работ измерения методом МСММ носят количественный характер, что позволяет выявить микробные доминанты воспалительного процесса на одной и той же пробе инфицированного материала в разных отделах организма, а также сопоставлять результаты измерений разных пациентов. Оказалось, что доминантами у 11 больных из 12 обследованных являются кишечные бактерии вида Propionibacterium freudenreichii, родов Eubacterium, Clostridium и Bifidobacterium. Такой тип инфекции показан на рис 22, где в графическом выражении лучше иллюстрируется количественные изменения относительно нормы и других составляющих микробного сообщества.

Рис. 22. Избыточный рост микроорганизмов (инфекция) полости матки. Доминируют маркеры кишечных микроорганизмов: клостридий группы C. ramosum, основной группы эубактерий (E. moniliforme, E.nodatum, E.sabureum), пропионобактерий (Propionibacterium freudenreichii). Клинически значимый уровень превышают маркеры превотелл, нокардий, энтерококков.
Серия анализов одной и той же больной показывает более чем десятикратное увеличение численности вида P. freudenreichii, родов Eubacterium и Bifidobacterium в матке и придатках по сравнению с уровнем колонизации влагалища в норме. В трубах и ткани яичников уровень колонизации бифидобактериями, эубактериями и пропионобактериями достигает 3-6 х 109 клеток/мл. При этом в эндометрии и ткани матки избыточного роста этих бактерий не наблюдается. В этом можно усматривать специфику инфицирования верхних половых органов, так как при вагинитах в слизистой влагалища их рост хотя и происходит, но не в такой степени. Для вагины более характерна инфекция Clostridium perfringens. При воспалениях, напоминающих по клиническим проявлениям кандидоз, их численность до 30 крат превышают уровень колонизации слизистой оболочки в норме. В исследованных пробах верхних отделов клинически значимых превышений маркера C. perfringens (10-гидрокси-стеариновая кислота) не обнаружено. Здесь регулярно участвует в воспалительном процессе другая группа клостридий – C. ramosum. Их численность до семи раз превышает норму в исследованных материалах. Из трудно культивируемых микроорганизмов, которые позволяет выявить масс-спектрометрический метод, следует отметить еще анаэробы Actinomyces viscosus, численность которых в ряде проб до пяти раз выше нормальной. В отдельных случаях в состав микст-инфекции включены аэробные (оральные) и анаэробные стрептококки S. mutans.
Выявляемые в клинических лабораториях при рутинных анализах микроорганизмы в рейтинговом положении оказываются во втором ранге смешанной инфекции верхних половых органов. Максимального уровня в этой группе достигает энтерококк – 108 клеток/мл. Тогда как перечисленные выше доминирующие анаэробы занимают порядки 108-1011. Грамотрицательные микроорганизмы Moraxella/Acinetobacter, P. aeruginosa, Haemophylus/Burkholderia, Prevotella, B. fragilis, H. pylori обнаруживаются в исследованных пробах в количестве 105-107 клеток/мл. Представители сем. Enterobacteriaceae присутствуют, но не выходят за пределы уровня колонизации вагины в норме.
Результаты этого анализа перспективны для выявления и консервативного лечения подобного рода заболеваний на ранних стадиях, а также уточнения механизма возникновения патологических изменений матки и придатков, приводящих к необходимости оперативного вмешательства. Обнаружение в послеоперационном материале огромного количества слизеобразующих кишечных микробов, равно как при муковисцидозе, простатите и пиелонефрите, дает основание предположить, что они могут вызывать нарушение нормальных физиологических процессов в органах не только за счет своих факторов патогенности (инвазия, эрозия, токсигенность и прочее), а также за счет физического перекрывания мембран и капилляров мукозной биомассой.
VII. Заключение
Приведенные здесь примеры в целом показывают, что диагностика возбудителей инфекционных процессов по данным масс-фрагментографии биологических жидкостей является экспресным, чувствительным и универсальным методом индикации, одинаково эффективным как для аэробных, так и для анаэробных микроорганизмов.
Он может быть использован для определения любого микроба, имеющего в составе структурных клеточных компонетов вещество-маркер, отличное от химических веществ фоновой биологической жидкости. Наши наблюдения и литературные данные свидетельствуют о достаточном количестве клеточных компонентов, специфичных сугубо для возбудителя, по которым его можно идентифицировать, используя индивидуальные или коллективные маркеры84.
Чувствительность метода составляет 104-105 клеток в пробе в зависимости от содержания маркера в клетке. В этом качестве метод уступает микробиологическому методу селективных сред, однако имеет преимущества в экспрессности.
В настоящее время для проведения анализа требуется примерно менее 3 часов на 1 образец, или 7 часов на серию из 5 проб, тогда как бактериоскопия занимает, как минимум, сутки. Экспрессность и универсальность анализа при возможности точного определения численности микроорганизмов позволили за короткий срок пополнить сведения о микробной этиологии многих заболеваний сердца и сосудов85, респираторных органов, кишечника, кожи86,87, мочеполовой сферы, печени, послеоперационных и травматических инфекций и дисбиозов. Полученные одновременно для каждого больного воспроизводимые данные по составу микроорганизмов, участников инфекционного процесса при оценке общего микроэкологического статуса, позволили врачу получить качественно новую обширную информацию для принятия адекватной антимикробной и общей терапии. В подтверждение достоверности результатов обследования методом МСММ следует отметить, что они соответствуют существующим прогрессивным представлениям об инфекции и дисбиозах. В том отношении, что инфекции в подавляющем большинстве случаев полимикробны, в них доминируют анаэробы, в воспалениях существенную роль в провоспалительных и противовоспалительных актах играет собственная автохтонная микробиота организма человека.
Литература
- Persing D.H. Polymerase chain reaction: trenches to benches.// J. Clin. Microbiol., 1991, Vol. 29, № 7, p. 1281-1285.
- Fenollar F., Roux V., Stein A., Drancourt M., Raoult D. Analysis of 525 samples to determine the usefulness of PCR amplification and sequencing of the 16S rRNA gene for diagnosis of bone and joint infections.// J. Clin. Microbiol., 2006, Vol. 44, № 3, p. 1018-1028.
- Михайлова Д.О., Бобылева З.Д., Базарный В.В., Амон Е.П., Бейкин Я.Б., Беседина Л.Т., Мельникова О.В., Шилова В.П., Розанова С.М., Перевалова Е.Ю. Диагностическое значение различных иммунологических методов лабораторной диагностики легионеллеза.// Журн. микробиол., эпидемиол. иммунобиол., 2008; № 2, с. 51-53.
- Осипов Г.А. Способ определения родового (видового) состава ассоциации микроорганизмов./Патент РФ № 2086642. С12N 1/00, 1/20, C12Q 1 /4, 24.12.1993.
- Осипов Г.А., Белобородова Н.В. Способ выявления возбудителя инфекционного процесса в стерильных биологических средах макроорганизма./ Патент РФ № 2146368, РФ 10.03 2000.
- Осипов Г.А., Шабанова Е.А., Недорезова Т.П., Истратов В.Г., Сергеева Т.И. Способ диагностики клостридиальной анаэробной газовой инфекции./ Патент РФ №2021608 кл.G01N 33/50, 15.10.1994, Бюл.№19.
- Luckey T.D. Overview of gastrointestinal microecology.// Nahrung, 1987, Vol. 31, № 5-6, p. 359-364.
- Suau A., Bonnet R., Sutren M., Godon J.J., Gibson G.R., Collins M.D., Doré J. Direct analysis of genes encoding 16S rRNA from complex communities reveals many novel molecular species within the human gut.// Appl. Environ. Microbiol., 1999, Vol. 65, № 11 p. 4799 – 4807.
- Stead, D.E., Sellwood, J.E., Wilson, J., et al. Evaluation of a commercial microbial identification system based on fatty acid profiles for rapid, accurate identification of plant pathogenic bacteria.// J.Appl.Bacteriol. 1992, 72, 315-321.
- Вейант Р., Мосс У., Холлис Д., Джордан Дж., Кук Э., Дейншвар М. Определитель нетривиальных патогенных грамотрицательных бактерий. М. Мир, 1999, c. 612-783
- White D.C. Validation of quantitative analysis for microbial biomass, community structure, and metabolic activity.// Adv. Limnol., 1988, №31, p. 1-18.
- Осипов Г.А. Демина А.М. Хромато-масс-спектрометрическое обнаружение микроорганизмов в анаэробных инфекционных процессах.// Вестник РАМН, 1996, Т.13, №2, с. 52-59.
- Турова Е.С., Осипов Г.А. Изучение структуры микробного сообщества, активного в биотрансформации минералов железа в каолине.// Микробиология, 1996, Т. 65, № 5, с. 682-689.
- Chemical Methods in Bacterial Systematics.//- Eds M. Goodfellow. D.E. Minnikin.- New York; London.-1985.
- Васюренко З.П., Фролов А.Ф., Смирнов В.В., Рубан Н.М. // Жирнокислотные профили бактерий, патогенных для человека и животных.// Киев. Наукова думка. -1992.
- Осипов Г.А. // Хромато-масс-спектрометрическое исследование микроорганизмов и их сообществ. Диссертация доктора биологических наук.// Москва. -1995.
- Moss C.W.,Dees S.R.// Identification of microorganisms by gas chromatographic — mass spectrometric analysis of cellular fatty acids.//J.Chromatography.-1985.-Vol.12.-P.595-604.
- Jantzen E., Bryn K. Whole-cell and lipopolysaccharide fatty acids and sugars of gram-negative bacteria. in: Chem. methods in bacterial systematics.- 1985.- Acad. Press.- p.145-172.
- Sonesson A., Larsson L., Westerdahl G., Odham G. Determination of endotoxins by gas chromatography: evaluation of electron-capture and negative-ion chemical ionization mass spectrometric detection of halogenated derivatives of b-hydroxymyristic acid. J.Chrom.,Biomed.Appl.- 1987.-Vol.417.-P.11-25.
- Andreev L.V., Akimov V,N., Nikitin D.I. Peculiarities of fatty acid composition of the genus Caulobacter. Folia Microbiol.31, 144-153(1986).
- Dennemont J., Roupas A., Heitz M. Differentiation of Campylobacter jejuni, C.coli, C.lary and C.fetus fatty acid profiles obtained by gas chromatography — mass spectrometry and by their hippurate hydrolysis. // Mitt. Geb.Lebensmittelunters.Hyg.- 1992.-Vol.83.-N2.-P.142-150.
- Morgan S.L., Fox A., Gilbart J. Profiling, structural characterization, and trace detection of chemical markers for microorganisms by gas chromatography — mass spectrometry. J.Microbiol.Methods.- 1989.Vol.9.-P.57-69.
- Larsson L. // Determination of microbial chemical markers by gas chromatography-mass-spectrometry – potential for diagnosis and studies on metabolism in situ. Review article.// -APMIS.-1994.-Mar. 102:3.-161-9
- Hui M, Cheung SW, Chin ML, Chu KC, Chan RC, Cheng AF. Development and application of a rapid diagnostic method for invasive Candidiasis by the detection of D-/L-arabinitol using gas chromatography/mass spectrometry. Diagn Microbiol Infect Dis. 2004 Jun;49(2):117-23
- Maitza S.K., Schotz M.C., Yoshikawa T.T., Guze L.B.// Defermination of lipid A and endotoxin in serum by mass-spectroscopy.// Proc.Natl.Acad.Sci.USA.-1978.-V.75.-P.3993.
- Brandtzaeg, P., Bryn, K., Kierulf, P., et al. 1992. Meningococcal endotoxin in lethal septic shock plasma studied by gas chromatography, mass-spectrometry, ultracentrifugation and electron microscopy. J.Clin.Investig. 89, 816-823.
- Sud I.J., Feingold D.S. Detection of 3-hydroxy fatty acids of picogram levels in biologic specimens. A chemical method for the detection of Neisseria gonorrhoae? The Journal of Investigative Dermatology. 1979,v.73,p521-526
- Bronds J., Olsen J. Chemotaxonomy at a crossroads? Gas chromatographic analysis of a single colony from the bacterium Haemophylus aphrophilus. J.Chrom.,Biomed.Appl. -1986.-Vol.374.-N1.-P.119-124.
- Larsson L., Saraf A., Axelsson B.-O. Determination of ergosterol in organic dust by gas chromatography-mass spectrometry. -1995. –666. –77-84.
- Larsson L., Saraf A. Use of gas chromatography-ion trap tandem mass spectrometry for the detection and characterization of microorganisms in complex samples. -Mol. Biotechnol.-1997.-Jun.7:3.-279-87.
- R Ferrando, B Szponar, A Sanchez, L Larsson, and PL Valero-Guillen. 3-Hydroxy fatty acids in saliva as diagnostic markers in chronic periodontitis. J Microbiol Methods, September 1, 2005; 62(3): 285-91.
- Brondz J., Olsen J. Microbial chemotaxonomy. Chromatography, electrophoresis and relevant profiling techniqnes. J. Chrom., Biomed. Appl. -1986.-Vol. 379.-P. 367-411
- Chemical methods in Procariotic Systematics (1994) ( Goodfellow, M. and O’Donnell, A.G., Eds.), John Willey and Sons, .Chiduster, UK
- Nichols P.D., Mancuso C.A., White D.C. Measurement of methanotroph and methanogen signature phospholipids for use in assessment of biomass and community structure in model system. Org.Geochem.-1987.-Vol.11.-No.6.-P.451-462.
- Shekhovtsova N.V., Osipov G.A., Verkhovtseva N.V., Pevzner L.A. Analysis of lipid biomarkers in rocks of the Archean crystalline basement. Proceedings of SPIE.- 2003.- Vol.4939.- P. 160 – 168
- N.V. Verkhovtseva, G.A. Osipov, T.N. Bolysheva, V.A. Kasatikov, N.V. Kuzmina, Ju.Antsiferova and A.S. Alexeeva. Comparative Investigation of Vermicompost Microbial Communities; In: “Microbiology of Composting”/ Ed. H.Insam, Springer-Verlag,GmbH&Co.KG, 2002,pp.91-111. Berli, Heidelberg, New York
- Н.В. Верховцева, Е.Б Пашкевич ,Г.А. Осипов ,Н.А Флесс , В.Г. Минеев. Изменение состава микробного сообщества дерново-подзолистой супесчаной почвы при внесении сидератов и соломы в качестве органических удобрений. Доклады РАСХН, 2002, №5, с.25-28
- Верховцева Н.В., Ларина Г.Е., Спиридонов Ю.Я., Степанов А.Л., Осипов Г.А. Микробные консорциумы почв агроценозов разных природных зон России с учетом их сельскохозяйственного использования. Проблемы агрохимии и экологии. 2008, № 2, С. 37-43.
- Ручкина И.Н. Диссертация доктора медицинских наук. Москва. -2006.
- Полеско И.В. Диссертация доктора медицинских наук. Москва. -2009.
- О’Лири. Липиды микроорганизмов: В кн. Молекулярная микробиология, М.. Мир, 1977, с. 201-239
- McNabb A., Shuttleworth R., Behme R. et al. Fatty acid characterization of rapidly growing pathogenic aerobic actinomycetes as a means of identification. J.Clin.Microbiol. 1997, v.35, N.6, p.1361-1368.
- Kaneda T. Fatty acids in the genus bacillus: an example of branched chain preferences. Bacteriol.Rev. 1977, 41:391-418
- Kaneda T. Iso- and anteiso-fatty acids in bacteria: biosynthesis, function and taxonomic significans. Microbiol.Rev.-1991.-Vol.55.-N2.-P.288-302.
- McNeil M.M., Brown J.M., Jarvis W.R., Ajello L. // Comparison of species distribution and antimicrobial susceptibility of aerobic actinomycetes from clinical specimens. // Rev Infect Dis 1990 Sep-Oct;12(5):778-83
- Manual of Clinical Microbiology. 5-th ed. Editor in Chief — Albert Balows. Washington, 1991, pp. 317-318.
- “Sherlock”, Microbial identification system. Database on microbial cellular fatty acids. MIDI Inc. Delavare, 1994.
- Nichols P.D., Leeming R., Rayner M.S., et al. (1996). Use of capillary gas chromatography for measuring fecal-derived sterols. J.Chrom.,A 733, 497-509.
- Mosca A., Summanen P., Finegold S M., De Michele G, and Miragliotta G. Cellular Fatty Acid Composition, Soluble-Protein Profile, and Antimicrobial Resistance Pattern of Eubacterium lentum. J. Clin.Microbiol., Mar. 1998, p. 752–755 Vol. 36, No. 3
- Moss C.W., Lambert M.A. Lombard G.L. Cellular fatty acids of Peptococcus variabilis and Peptostreptococcus anaerobius.. J. Clin.Microbiol. 1977, 5(6), 665-7.
- Zhilina, T. N., Kotsyurbenko, O. R., Osipov, G. A., Kostrinka, N. A.& Zavarzin, G. A. (1995). Ruminococcus palustris sp. nov. — a psychroactive anaerobic organism from a swamp. Microbiology (English translation of Mikrobiologiya) 64, 674-680
- Takatori T, Ishiguro N, Tarao H, Matsumiya H. Microbial production of hydroxy and oxo fatty acids by several microorganisms as a model of adipocere formation. Forensic Sci Int 1986 Aug-Sep;32(1):5-11
- Allen S.D., Siders J.A., Riddell M.J., et al. Cellular fatty acid analysis in the differentiation of Clostridium in the clinical microbiology laboratory. Clin.Infect.Dis. 1995 Jun;20 Suppl 2:S198-201.
- Miyagawa E., Azuma R., Suto T. Cellular fatty acid composition in gram-negative obligately anaerobic rods. J.Gen.Appl.Microbiol.-1979.-Vol.25.-P.41-51.
- Mayberry W.R., Lambe D.W.,Jr.; Ferguson H.P. Identification of Bacteroides species by cellular fatty acid profiles. Int.J.Syst.Bacteriol.-1982.-Vol.32(1).-p.21
- Brondz I., Olsen I. (1991) Multivariate analyses of cellular fatty acids in Bacteroides, Prevotella, Porhyromonas, Wolinella and Campylobacter spp. J.Clin.Microb., V 29 (1) :183-89.
- Tsuchiya H., Masaru S., Kato M. et al., High-Perfomance Liquid Chromatographic analysis of bacterial fatty acid composition for chemotaxonomic characterization of oral streptococci.// J. Clin.Microbiol., 1986, 24(1), 81-85.
- Vuorio, R, MA Andersson, FA Rainey, RM Kroppenstedt, P Kampfer, HJ Busse, M Viljanen, and M Salkinoja-Salonen A new rapidly growing mycobacterial species, Mycobacterium murale sp. nov., isolated from the indoor walls of a children’s day care centre Int. J. Syst. Bacteriol., Jan 1999; 49: 25.
- Axelsson B.-O., Saraf A., Larsson L. Determination of ergosterol in organic dust by gas chromatography — mass spectrometry. // J. Chromatogr.B, 666 (1995) 77-84.
- Howell SA, MK Moore, AI Mallet, and WC Noble. Sterols of fungi responsible for superficial skin and nail infection.J Gen Microbiol, Feb 1990; 136(2): 241-7.
- J.S.Sadler et al. J.Gen/Microbiol 1987,133,1137-1147
- Geis G., Leying H., Suerbaum S., Opferkuch W. Unusual fatty acid substitution in lipids and lipopolysaccharides of Helicobacter pylori. J.Clin.Microbiol. 1990, 28(5): 930-932
- Birek C., Grandhi R., McNeil K. et al. Detection of Helicobacter pylori in oral aphthous ulcers. J.Oral.Pathol.Med. 1999, 28(5): 197-203
- Farsak, Bora ; Aylin Yildirir, Yakut Akycn et al. Detection of Chlamydia pneumoniae and Helicobacter pylory DNA in Human Atherosclerotic Plaques by PCR. — J.Clin.Microbiol. 2000 V.38,№ 12: 4408-4411.
- Jantzen E., Berdal B.P., Omland T. Fatty acid taxonomy of Haemophilus species, Pasteurella multocida, Actinobacillus actinomycetemcomitans and Haemophilus vaginalis (Corinebacterium vaginale). Acta Path.Microbiol.Scand. 1991, 88B: 89-93
- Stoakes L., John M.A., Lannigan R. et al. Gas-liquid chromatography of cellular fatty acids for identification of staphylococci. Clin.Microbiol. 1994 Aug.; 32(8): 1908-10
- Bernard K.A, Bellefeuille M., Ewan E.P. Cellular fatty acid composition as an adjunct to the identification of asporooogenous, aerobic gram-positive rods. J.Clin.Microbiol. 1991, 29(1): 83-89.
- Nurminen M. Chemical characterization of Chlamydia trachomatis LPS. — Infection and Immunity. 1985, 48(2): 573-75
- Schaechter M., Medoff G.,Eisenstein B.J. (Eds). Mechanisms of Microbial Disease. Williams & Wilkins. 1993. P. 699.
- Hopkins M.J., R. Sharp, G.T. Macfarlane, 2001. Age and disease related changes in intestinal bacterial populations assessed by cell culture, 16S rRNA abundance, and community cellular fatty acid profiles. Gut; 48;198-205.
- Осипов Г.А., Парфенов А.И., Верховцева Н.В., Ручкина И.Н., Курчавов В.А., Бойко Н.Б., Рогатина Е.Л. Клиническое значение исследования микроорганизмов слизистой оболочки кишечника культурально-биохимическим и хромато-масс-спектрометрическим методами. Эксп. Клин. Гастроэнтерология. 2003. Т. 4, С. 59-67
- Osipov G.A., Boiko N.B., Verkhovtseva N.V. et al. Preliminary differentiation of bacteria in clinical and environmental samples by fatty acid features and profiles. 4-th Int.Symp. on the Interface between Analytical Chemystry and Microbiology, June 4-7, 2000, Tregastel — Bretagne, France. Thesis
- Bergey’s Manual of Systematic Bacteriology.// Baltimore,London.- Wilians&Wilkins.- 1984.
- Andersson MA, M Nikulin, U Koljalg, MC Andersson, F Rainey, K Reijula, EL Hintikka, and M Salkinoja-Salonen. Bacteria, molds, and toxins in water-damaged building materials. Appl. Envir. Microbiol., Feb 1997; 63: 387 — 393.
- Белобородова Н.В., Осипов Г.А. Гомеостаз малых молекул микробного происхождения и его роль во взаимоотношениях микроорганизмов с хозяином. Вестник РАМН. -1999. T.16, -№7, с. 25-31.
- Beloborodova N.V., Osipov G.A. // Small molecules originating from microbes (SMOM) and their role in microbes-host relationship.// Microb. Ecol.Heal.Dis., SCUP. — 2000.- Vol. 12. – P. 12-21.
- Шендеров Б.А. Медицинская микробная экология и функциональное питание. Издание в 3-х томах, Т1. -М., Грант, 1998
- Ionescu G, Kiehl R, Ona L, Schuler R. Abnormal fecal microflora and malabsorption phenomena in atopic eczema patients. J Adv Med 1990; 3:71-89.
- Осипов Г.А, Федосова Н.Ф., Лядов К.В. Количественный in situ микробиологический анализ по липидным маркерам в биологических жидкостях с использованием метода газовой хроматографии – масс спектрометрии. Здравоохранение и медицинские технологии № 5 2007 стр. 20-23.
- Крымцева Т.А., Осипов Г.А., Бойко Н.Б., Соколов Я.А., Демина А.М., Радюшина Т.В., Осипов Д.Г.. Минорные жирные кислоты биологических жидкостей урогенитальных органов и их значимость в диагностике воспалительных процессов. Журн. Микроб. Эпидем. Иммун. 2003, № 2: 92-101
- Осипов Г.А., Крымцева Т.А., Осипов Д.Г., Столярова О.Н. Функциональные изменения жирнокислотного состава урогенитальных жидкостей организма человека при дисбиозах. Прометей. Москва, 2005
- Сидорова И.С. , Макаров И.О., Шешукова Н. А. Воспалительные заболевания внутренних половых органов. Практическая медицина. Москва, 2007.
- Wilkins M., Thin R. N., Tabaqchall S. Quantitave bacteriology of the vaginal flora in genital disease // J. Med. Microbiol. 1984, 18:2, 217-231.
- Osipov G.A., Turova E.S. Studying species composition of microbial communities with the use of gas chromatography-mass spectrometry. Microbial community of kaolin. FEMS Microbiol.Rev. 1997, 20: 437-446.
- Хабиб О.Н. Белобородова Н.В. Осипов Г.А. Детектирование молекулярных маркеров бактерий в ткани клапанов сердца в норме и при патологии с применением метода газовой хроматографии и масс-спектрометрии Журн. Микроб. Эпидем. Иммун., 2004, Том 7, № 3: 62-68
- Полеско И.В., Бутов Ю.С., Осипов Г.А., Малиновская В.В. Спектрометрическое исследование состава микроорганизмов кишечника у больных себорейным дерматитом. Рос. журн. кож. и вен. бол. -2006, № 3, с.23-27
- Полеско И.В., Бутов Ю.С., Осипов Г.А., Кабаева Т.И., Парфенов В.В., Деленян Н.В. Состав кожного сала, микроэкология кожи и кишечника у больных себорейным дерматитом и акне (исследование методом газовой хроматографии масс-спектрометрии). Рос. журн. кож. и вен. бол. -2007, № 2, с.43-50